en
names in breadcrumbs

El virus de la pesta porcina africana (VPPA) és un virus d'ADN bicatenari, de mida gran, de simetria icosaèdrica i amb embolcall extern.[1] Antigament, aquest virus es classificava com a membre de la família Iridoviridae i, actualment, és l'únic membre del nou gènere Asfivirus de la família Asfarviridae. El VPPA es transmet per artròpodes i causa la pesta porcina africana (PPA).[2]
La pesta porcina africana (PPA) és una malaltia viral hemorràgica, contagiosa i infecciosa que afecta als porcs domèstics i salvatges de qualsevol edat.[3] La virulència de les soques del virus de la pesta porcina africana (VPPA) varia des de soques altament patògenes que poden arribar a causar el 100% de la mortalitat fins a soques de baixa patogenicitat que poden ser difícils de diagnosticar.[2] Les soques altament patògenes es caracteritzen per provocar febre alta, pèrdua de gana, hemorràgies de la pell i òrgans interns i mort entre 2 i 10 dies després.
La PPA és generalment prevalent i endèmica en els països de l'Àfrica Subsahariana. En el continent europeu és endèmica únicament a Sardenya.[3] Degut a la gran capacitat de propagació del VPPA fa que aquest sigui una de les amenaces infeccioses més importants per a la indústria del porc domèstic a tot el món, causant efectes devastadors en la producció i grans pèrdues econòmiques als països afectats.[2] La malaltia causada pel VPPA es troba inscrita en el Codi Sanitari pels Animals Terrestres de l'Organització Mundial de Sanitat Animal (OIE) i és de declaració obligatòria a l'OIE.[3]
Criptograma: D/2: 130-160/12-16: Se/S: I,V/C,I,O,Ve/Ac
Aquest virus presenta un elevat pes molecular, tot i que el seu genoma només en forma una petita part, per tant, aquest fet demostra que presenta una elevada complexitat, la qual es pot veure amb la presència de bastantes capes en el seu embolcall extern.
Al ser ADN bicatenari es replica dins el nucli de la cèl·lula.
Afecta tant a vertebrats com a invertebrats.
Es pot transmetre per via congènita, digestiva a través de femtes i/o a través de secrecions i lesions a la pell per contacte directe. També es pot transmetre per vectors com les paparres de l'espècie Ornithodoros moubata.
Aquest virus es sol trobar entre els fluids corporals i en diversos teixits.[4]
L'evolució d'aquest virus depèn d'una sèrie de factors, principalment, de la virulència del virus i de la resistència de l'animal. Aquesta malaltia pot seguir un curs de tipus sobreagut, agut, subclínic o crònic. La forma sobreaguda de la malaltia, sol presentar la mort sense símptomes anteriors o una lleugera etapa febril. La forma aguda i la subaguda es diferencien per la intensitat i la duració dels símptomes que es caracteritzen per presentar durant els primers dos o quatre dies febre d'entre 40 i 42 °C però que no els origina trastorns, passats aquests dies, apareixen els senyals relacionats amb la febre com l'anorèxia, falta de moviment o moviment vacil·lant, tos, dispnees, tremolors, parexia o debilitat sobretot del terç posterior, atàxia, alteracions gastrointestinals, circulatòries i vasculars. També presenten cianosi a la pell i hemorràgies en òrgans interns, d'intensitat variable que tendeixen a augmentar, afecten sobretot als ganglis limfàtics, ronyons i mucosa gastrointestinal. També es poden observar les mucoses inflamades i envermellides. Pot ser que apareguin lesions a la pell amb àmplies zones necròtiques, úlceres al morro i a les orelles, hematomes escrotals i conjuntivitis. Les lesions a la pell es solen notar sobretot en porcs blancs, als quals se'ls veuen envermellides les extremitats i la zona abdominal. Finalment es dóna la mort entre els 12 i els 14 dies en els casos aguts, i als 15 o 20 en els subaguts.[5][6] Els òrgans interns més afectats per aquesta patologia són:[7]
En les formes cròniques la simptomatologia gairebé no s'aprecia, només es pot detectar per la pèrdua de pes dels animals. Els animals que superin aquesta patologia es trobaran en un estat o subclínic o crònic i es convertiran en portadors, però no és massa probable. La simptomatologia és molt semblant a la de la pesta porcina clàssica, per tant, s'ha de recórrer a les proves diagnòstiques per diferenciar-les.
La PPA va ser descrita per primera vegada per Montgomery a Kenya el 1921. Com ja hem vist, aquesta malaltia és endèmica en la major part de l'Àfrica Subsahariana (incloent l'illa de Madagascar) i la major incidència s'observa des l'Equador fins al nord de Transvaal.[8] Des d'Àfrica va arribar a Europa, en concret, a Portugal el 1957 i el 1960 va colonitzar Espanya, França i Bèlgica. A partir d'aquí, el virus va arribar a Amèrica Llatina durant els anys 70 i els anys 80.[1] A Espanya i Portugal l'erradicació completa va portar més de 30 any i durant els brots a Malta i República Dominicana tot el bestiar porcí porcs d'aquests països es van extingir completament.[2] A Europa el VPP continua present a Sardenya i, recentment, s'ha tornat a introduir a Geòrgia el 2007.[1] Molt probablement aquesta última introducció a les fronteres d'Europa és deguda a una infecció a través de carn de porc descarregada d'un vaixell, la qual va ser utilitzada per alimentar a porcs d'aquella zona. Més endavant es va estendre a la regió del Caucas i Rússia.[8] Posteriorment s'ha disseminat cap a altres països d'Europa Oriental. A l'any 2018, la malaltia ha aparegut en porcs domèstic de la Xina i en seglars a Bèlgica.
La PPA, normalment, s'associa amb una alta morbiditat i mortalitat.En les regions endèmiques la taxa de mortalitat ha disminuït i les infecciones cròniques subclíniques cada cop són més freqüents. Aquests porcs amb infeccions cròniques és probable que ocupin un paper important en l'epidemiologia de la PPA, per la persistència de la malaltia en les zones endèmiques i per causar brots esporàdics o la introducció lliure de la malaltia.[9]
Les espècies susceptibles a ser infectades són el porc (Sus scrofa domestica), el senglar (Sus scrofa), el facoquer africà (Phacochoerus africanus), el porc senglar de riu (Potamochoerus porcus), l'hiloquer (Hylochoerus meinertzhageni) i els pècaris (Tayassu spp.). Les infeccions simptomàtiques es produeixen en els porcs i en els senglars. Les infeccions pel VPPA generalment són asimptomàtiques en el falconer africà, el senglar de riu i l'hiloquer,[10] els quals no tenen un paper important en l'epidemiologia d'aquesta malaltia.[9] Hi ha altres espècies que poden transportar el virus sense símptomes com el pècari de collar (Tayassu tajacu) i el pècari de llavi blanc (Tayassu albirostris), tots dos originaris d'Amèrica.[10] Els reservoris naturals són totes aquestes espècies que no presenten símptomes clínics, a més a més, de les paparres toves (gènere Ornithodoros) perquè es creu que el VPPA és un virus ancestral d'aquests artròpodes.[1] Pel que fa a les espècies que no presenten símptomes no tenen un paper important en l'epidemiologia.
La PAA es pot transmetre per contacte directe a través de secrecions i excrecions amb els animals infectats o per contacte indirecte a través de fómites i vectors com les paparres. L'entrada del virus en el porc normalment ocorre per via oronasal, encara que també es pot donar per via cutània (escarificació), subcutània, intramuscular i intravenosa, a causa de la picada de paparres. L'eliminació del virus pot produir-se per totes les vies.
La transmissió per contacte directe generalment es produeix per via oronasal a través de secrecions nasals, saliva, femta, orina, exsudat conjuntival, exsudat genital i ferides sagnants.[2] Es creu que la transmissió per aerosols no és important i només sembla ocórrer quan els porcs es troben en proximitat. El VPAA es pot trobar en tots els teixits i fluids corporals, però els nivells més elevats es troben principalment a la sang. Així, es pot produir una contaminació ambiental massiva si vessa sang durant la necròpsia, quan es produeixen ferides per baralles entre animals o si un porc presenta diarrea amb sang.
Aquest virus també es pot propagar a través de fómites (locals, vehicles, aliments, materials de treball, material quirúrgic, personal, abeuradors, etc.). El VPPA és altament resistent a les condicions climàtiques.[10]
També es propaga a través de la picada de paparres toves Ornithodoros spp. infectades. Ornithodoros erraticus es va identificar per primera vegada com un vector biològic i un reservori del VPPA a Espanya, que va portar a la descobriment que les paparres de Ornithodoros moubata juguen un paper en l'epidemiologia de la malaltia a l'Àfrica. Les paparres Ornithodoros moubata complex són àmpliament distribuïdes al sud d'Àfrica i també són presents a Madagascar i es creu que troben absents a l'Àfrica Occidental.[9] En les poblacions de paparres es pot produir la transmissió transestadial, transovàrica i sexual.[10] Aquestes paparres toves viuen en els caus dels porcs domèstics i salvatges i és allà on mosseguen a individus joves i poden transmetre el VPPA, el qual persisteix en els ganglis limfàtics.[9] La replicació primària té lloc en aquests ganglis limfàtics i, a partir d'aquí, el virus es dissemina per via sangínia i/o limfàtica. A mesura que el virus arriba a diferents òrgans on es produeix la segona replicació, que destrueix el teixit de l'interior dels vasos sanguinis i es produeix hemorràgies.[10] El VPPA es multiplica en les paparres i pot persistir-hi durant molt de temps.[1] Altres insectes xucladors de sang, com ara els mosquits i les mosques, també poden transmetre el virus de forma mecànica.[10]
El període d'incubació és de 5 a 19 dies després del contacte directe amb porcs infectats, però pot ser menor a 5 dies després de l'exposició a les paparres. Generalment, la malaltia aguda apareix en 5 a 7 dies.[2]
El VPPA és molt resistent a la inactivació. A causa de la prolongada persistència del virus en teixits fan que els productes del porc insuficientment congelats, cuinats o curats poden romandre infectats durant diversos mesos i ser una font d'infecció molt important. A més a més, aquest virus pot persistir en l'ambient durant diversos dies.[9]
Actualment, no hi ha vacuna ni tractament documentats per la PPA. La prevenció als països lliures de la malaltia depèn de l'adopció de polítiques restrictives d'importació i l'eliminació adequada de les restes de menjar dels avions, vaixells o vehicles procedents de països infectats. A les zones endèmiques és difícil eliminar els reservoris naturals, no obstant això, el control del vector és important per a la prevenció. També és important assegurar-se que no s'utilitzi carn de senglars o d'animals infectats en els aliments dels porcs sensibles. Els programes d'erradicació inclouen un diagnòstic ràpid, sacrifici i eliminació de tots els animals de les explotacions infectades, neteja i desinfecció completes, control d'insectes i paparres i control del moviment i vigilància.[3]
L'anàlisi de diferents virus aïllats va determinar que aquests afecten a individus salvatges molt diferents a l'est i al sud d'Àfrica, reflectint una evolució a llarg temps en poblacions d'hostes separades geogràficament. Gràcies a aïllaments d'aquests virus a partir de porcs domèstics a l'Àfrica occidental i central, Europa, Carib i al Brasil obtinguts durant un període total de 40 anys es va observar com tots estaven fortament relacionats, suggerint que aquest derivaven dels aïllats dels individus de vida salvatge. [11]
Al Senegal el VPPA va ser identificat per primera vegada el 1959, i des de llavors es van donar freqüents brots del virus i se li va informar a l'Organització Mundial de la Salut Animal (OIE). Des de 1986 s'han documentat un total de 54 brots, 19 dels quals van ser documentats entre els anys 1986-1989 i 15 entre 1999-2003. En aquestes dates la freqüencia dels brots va ser més gran en comparació a la freqüencia d'aparició de casos d'VPPA entre 1989-1998 i 2004-2006 on es va reportar un total de 15 i 5 brots del virus respectivament. El suggeriment que es va fer al Senegal va ser el d'un cicle domèstic d'infecció que afeta les paparres i pot ser la causa de la naturalesa enzoòtica de la malaltia al país. Tot i això, la transmissió per contacte directe sembla ser el principal cicle d'infecció.
Entre 2002-2007 es van donar 11 casos d'VPPA. [12]
A Malawi es van dur a terme uns experiments per a determinar la prevalença del VPPA. El virus es va considerar com enzoòtic entre els anys 1981-1986 en la part occidental de la regió central, on els brots eren freqüents. Al sud es van detectar brots de forma intermitent i al nord no es va detectar cap brot important del VPPA. Basant-se en aquestes observacions es va creure que soques del VPPA de baixa virulència eren presents al país, però no es va donar cap prova experimental científica. [12]
En el cas de Moçambic, en un estudi realitzat en 1998, es van detectar anticossos del VPPA en porcs sans al districte de Angónia, prop de la frontera amb Malawi, el que indica que aquests porcs van sobreviure un brot. No obstant això, els experiments van mostrar que aquesta resistència no era altament heretable. [12]
A Tanzània el VPPA circulant és p72 de genotip II, el qual és idèntic a l'aïllat a Geòrgia en 2007. El brot de VPPA en porcs domèstics va ocórrer al novembre del 2012 al districte de Kyela, a la regió de MBeya, al sud-oest de Tanzània, que va coincidir amb un altre brot al districte veí de Karonga al nord de Malawi. El VPPA es va continuar expandint fins que va arribar a la veïna regió d'Iringa, situada al districte de Ludewa al febrer de 2011 a través de l'alimentació de porcs amb deixalles procedents de Mbeya. Per març del 2011, el virus es va expandir fins a Chunya, Ileje, Mbarali, Rungwe, i Turkuyu, districtes presents dins de la regió de Mbeya. Aquesta malaltia es va expandir per la regió a causa de la falta de mesures zoosanitàries i el tràfic il·legal d'animals. Així doncs, es va donar un brot del VPPA en una granja del districte de Temeke a la regió de Dar es Salaam a l'est de Tanzània al març del 2011 després que un ramader obtingués porcs de Mbeya. En aquesta regió no es van observar més casos després de les mesures preses per a l'erradicació del virus a la zona.
A l'octubre del 2011 la malaltia va passar fins al districte de Sumbawanga a la regió de Rukwa.
Al febrer del 2012 es van documentar casos en Ifakara, present al districte de Kilombero a la regió de Morogoro i al julio del mateix any al districte de Kilosa. [13]
Hi ha una advertència de part de la FAO amb motiu d'un risc d'entrada del VPPA des de la federació Russa. És per això perquè La FAO fa una crida a aquells països limítrofs amb la Federació Russa demanant-los que estiguin en alerta màxima de cara a aquest virus i que haurien d'invertir a millorar en la millora de la seva capacitat per detectar i respondre a un brot. Aquesta afirmació ha estat avaluada en una avaluació de riscos publicat per EMPRES Watch (Sistema de prevenció d'emergència). És de ressaltar que aquesta advertència de part de la FAO ha estat present des de l'any 2008.
Segons l'últim bolletí, la FAO reporta que el VPPA es va introduir l'any 2007 a la Federació Russa molt probablement des de Geòrgia. Donada la situació actual (de baixa bioseguretat,), la possibilitat d'erradicar la pesta porcina africana ràpidament de la Federació de Rússia és baixa, i la malaltia "és probable que continuï amenaçant la seguretat alimentària de tota l'Europa de l'Est durant anys, si no dècades per venir'. La FAO identifica el moviment de la carn infectada, la qual es destina per a la mateixa alimentació del sector porcí i esta com la via més probable pel qual el VPPA podrien ser introduïts a “no només els països veïns de la Federació de Rússia, sinó també molt més lluny”. [14] [15] [16]
El procés de formació de les estructures del virus de la pesta porcina africana té lloc en àrees específiques del citoplasma anomenat la "fàbrica vírica", localitzat a prop del nucli i del centre d'organització de microtúbuls. Quan la morfogènesis comença hi ha un augment gradual de la grandària de la fàbrica, ocupant cada cop més espai al citoplasma. També hi ha una acumulació de mitocondris a la perifèria.
L'acumulació de membranes virals a prop de la fàbrica és la primera indicació que està tenint lloc l'assemblatge d'un virus, aquestes estructures són els precursors de les capes internes de la partícula vírica. Els precursors poden estar presents com a petits estructures obertes i corbes, tot i que també apareixen organitzades paral·lelament separades per material electrodens i de vegades entre les cisternes del reticle endoplasmàtic.
Un altre tipus d'estructura que es pot observar en aquest punt dins i fora dels llocs d'assemblatge (però sempre a prop de la fàbrica vírica) són estructures víriques aberrants amb forma de cremallera. Aquestes consisteixen en proteïnes allargades, de 30 nm de gruix i amb dominis similars a la closca nuclear de la partícula vírica. Aquestes estructures tindran dos membranes lipídiques als costats, les quals seran similars a la capa interna en forma de cremallera trobat dins les fàbriques víriques mentre que als marges dels llocs d'assemblatge hi haurà cisternes del RE amb espais luminals evidents. Per aquest motiu es diu que la capa interna prové de les cisternes del RE col·lapsades i que conté dos membranes oposades unides íntimament.
Per mètodes de senyalització es va veure que les cisternes que es formaven al RE eren reconegudes pels mateixos anticossos que les capes internes de les membranes de les estructures víriques marginals (mateixa procedència). També es va veure que hi havia proteïnes de membrana del RE en membranes que estaven dins de la fàbrica vírica, com a membranes d'intermediaris d'assemblatge, en virions madurs i en virus extracel·lular. Eren tots reconeguts per un anticòs que té afinitat per quatre proteïnes del RE. També hi ha una proteïna de la família multi-gen 110 (ORF XP124L), que codifica una proteïna que es desplaça al lumen del RE, trobada retinguda al lumen després de la síntesi i es va detectar en intermediaris vírics d'assemblatge i en virions madurs. Aquests fets van ser interpretats com que el VPPA s'embolicava per les cisternes del RE, contribuint a donar consistència a la idea que dues membranes estan presents a la capa interna vírica.
En conclusió, les evidències morfològiques i immunoquímiques indiquen clarament que els precursors de les membranes víriques deriven de les cisternes del RE, les quals són reclutades per la fàbrica i modificades.
Les anàlisis fetes amb microscopis d'electrons de les fàbriques víriques mostren que la càpside es forma a la part convexa de les membranes víriques, les quals es converteixen en formes polièdriques per forces dependents d'ATP i de calci. A part de la proteïna major de càpside p72, l'assemblatge de la càpside depèn de la proteïna pB602L, que és una proteïna no estructural que actua com una xaperona i que actua com a suport de la proteïna major p72 i de la proteïna pB438L, un component menor de la càpside involucrat probablement en la formació dels vèrtexs d'aquesta.
Simultàniament a l'assemblatge de la càpside, la closca nuclear es forma per sota de la part còncava de l'embolcall víric. Aquest domini sembla que està constituït per dos "arranjaments cel·lulars" de subunitats globulars de 10 nm subdividits en capes electrodenses fines. Els principals constituents del domini "core shell" són productes proteolítics de les dues poliproteïnes dels virus, pp220 i pp62. La presència també de la proteasa pS273R en aquest domini i de la distribució subcel·lular de les poliproteïnes i dels seus productes en alguns experiments de "pols-caça" indica que el processament de polipropilè de proteïna s'acobla al conjunt del nucli.
Les poliproteïnes pp220 i les pp62 interaccionen entre elles per formar la closca nuclear per sota la capa interna lipídica. L'expressió d'ambdues proteïnes condueix al tancament de cremallera, que són estructures semblants a les de la closca delimitat a les dues bandes per les membranes de lípids. En canvi, quan s'expressen soles les pp220 s'uneixen als lípids de membrana per la seva fracció N-terminal que dóna lloc a les capes denses limitat per una membrana. Per això, és temptador especular que les estructures de cremallera consisteixen en dues unions de membranes contenent pp220 en les capes oposades interconnectades per precursor de pp62, mentre que les cremalleres apareixen preferentment associades a cisternes RE en infeccions de VPPA, estan units principalment a membrana plasmàtica i membranes endolisosomals en els experiments d'expressió transitòria. Aquest fet suggereix que no només l'acilació està involucrada en l'adequada senyalització a la membrana de la proteïna pp220.
Una organització similar a la de les cremalleres també té lloc en el desenvolupament de la closca nuclear de partícules normals del VPPA. Tot i que, a diferència de les cremalleres, la closca nuclear és una estructura asimètrica delimitada a la part externa per una capa lipídica i interiorment per un nucleoide amb un contingut de DNA.
Aquesta diferència podria ser explicada per canvis addicionals estructurals que tenen lloc durant l'assemblatge de la partícula vírica, on la formació del centre i la càpside són processis concomitants. Les cremalleres aberrants constituïdes per poliproteïnes pp220 i pp62 no processades són acumulades en infeccions amb un nombre condicional de virus letals mutants segrestats directament o indirectament en la formació de la càpside. Per tant, sembla probable que l'assemblatge progressiu de la capa de la càpside a l'embolcall intern determina d'alguna manera l'assemblatge adequat d'un centre asimètric per sota l'embolcall.
La formació del nucleòtid és l'últim pas en la morfogènesi del VPPA. En les fàbriques víriques apareixen partícules icosaèdriques que poden presentar un nucleoide central electrodens. Hi ha dos models per explicar aquest pas:
Un d'ells suggereix que aquests complexes nucleoproteids són pre-formades en la unió de la fàbrica a les membranes a prop de les partícules "buides", i que llavors en un vèrtex són encapsulades dins aquestes partícules. Aquest mecanisme no s'ha confirmat.
El model alternatiu sosté que el DNA viral primer és encapsulat (segurament juntament amb nucleoproteïnes) i llavors és condensat dins el virus en procés de formació per a produir els virions completament formats. A favor d'aquest model s'han descobert alguns detalls de la formació d'aquests virus, com que l'expressió de les lipoproteïnes pp220 i pp62 han mostrat que la incorporació del genoma viral i de les nucleoproteïnes p10 i pA104R a la partícula vírica depèn de l'assemblatge previ de la closca interna.
Tot i així, aquest mecanisme no ha de ser molt efectiu, ja que és freqüent observar partícules víriques "buides".[17]
La via d'entrada determinarà si una infecció serà productiva o no. Perquè aquesta ho sigui haurà d'entrar per les vies respiratòries per poder infectar les vies respiratòries altes i la primera replicació té lloc al teixit limfoide.
L'entrada és deguda a interaccions amb les promotors dels receptors celulars.
Aquesta entrada serà degut a una endocitosi regulada per un conjunt de proteïnes i lípids que són reclutats en una seqüència temporal, aquestes molècules prenen part en la unió de la membrana i la seva elongació, però també en la fissió final de les vesícules endocítiques.
Una part de la membrana plasmàtica de la cèl·lula s'invaginarà creant una petita vesícula intracel·lular recobert per proteïnes adaptadores de clatrina (Epsina15 i Dinamina). Llavors es reclutarà molècules relacionades amb la senyalització de l'actina, aquesta última molècula juntament amb la Dinamina es posaran a la base del coll de la vesícula i provocaran l'escissió de la capa formada pels adaptadors de clatrina i fent que aquesta entri dins de la cèl·lula.
El VPPA també inclou una altra entrada dins de la cèl·lula, que serà per macropinocitosi.
Els virions arriben a la zona perinucler, prop del centre organitzador de microtúbuls, lloc de replicació. Un dels passos més importants en la maduració endosomal inclou la progressió d'aquest endosoma cap a l'àrea perinuclear, i aquesta progressió la realitzen pels microtúbuls. Així doncs, el tràfic d'aquest virus es basa en els microtúbuls, i de fet, per una correcta infecció és necessari el correcte funcionament d'aquests. Per altra banda, l'activació de Rac1, la qual estabilitza els microtúbuls, també és crucial durant la infecció.[18]
La transcripció del VPPA comença a utilitzar enzims de processament, que es troben empaquetats en el nucli del virió. Aquests enzims necessiten que la replicació del DNA comenci immediatament després que el virus entri al citoplasma.
El lloc principal de replicació d'aquest virus és al citoplasma, de totes maneres la replicació del VPPA presenta una fase inicial al nucli. De fet el seu ADN es pot trobar en els llocs de replicació del nucli i del citoplasma.
Fragments curts de DNA nuclear viral són sintetitzats a prop de la membrana nuclear, i després, són transportats a la fàbrica de replicació citoplasmàtica. L'ADN que es troba en les partícules virals madures deriva de dos fragments, nuclear i citoplasmàtic.
D'altra banda les proteïnes virals p37 i p14 poden dirigir-se al nucli. Aquestes proteïnes són producte de la pp220, una poliproteïna que es troba a l'escorça nuclear del VPPA. La p37 és transportada al nucli i exportada al citoplasma, i pot estar implicada en el transport nucleocitoplàsmic de l'ADN de VPPA.
Estudis recents diuen que la infecció de VPPA alteren l'oragnització nuclear en una primera etapa de la infecció.
El genoma del virus de la PPA està format per una molècula d'ADN lineal de doble cadena, amb una mida aproximada d'entre 170 -193 Kb. Aquest codifica per uns 151-167 marcs de lectura d'obertura (ORF), i de fet, les diferències en la mida del genoma i el nombre de gens són en gran part a causa del guany i la pèrdua d'aquests ORFs. Hi ha com a mínim 22 genotips diferents d'aquest virus.
El virus de la pesta porcina africana es replica al citoplasma, mentre que la síntesi de l'ADN viral té lloc al nucli. Aquest virus té una transcriptasa pròpia i una RNA polimerasa RNA depenent.[19]
En porcs infectats, els monòcits i els macròfags semblen ser les principals cèl·lules diana del virus de la PPA. La replicació del virus provoca l'arrodoniment i la inflamació de les cèl·lules, conjuntament amb la marginació de la cromatina nuclear.
La replicació del virus indueix la necrosi de les cèl·lules afectades i l'alliberament de partícules víriques citoplasmàtiques sense embolcall, que seran observades a la sang, la limfa i el teixit intersticial.[20]
El període d'incubació varia entre 3 i 21 dies, depenent de la ruta d'exposició.[19]
Seguint una infecció oro-nasal o intramuscular, el virus es replica principalment a les cèl·lules fagocítiques mononuclears de les tonsil·les i dels limfonodes mandibulars (o altres limfonodes regionals), estenent-se per la limfa i la sang fins als òrgans de replicació secundaris, on podrà ser detectat durant els 2 – 3 dies posteriors a la infecció (dpi).[20] Quan el virus s'estén per la sang s'anomena virèmia, durant l'inici de la qual encara no es mostren els primers signes clínics.[19]
En aquests òrgans secundaris, la replicació s'observa majoritàriament als macròfags, però durant les fases centrals o finals de la pesta porcina africana aguda (5 – 7 dies posteriors a la infecció), l'evidència de la replicació viral es troba a cèl·lules no-fagocítiques, cèl·lules epitelials i/o cèl·lules mesenquimàtiques, un fenomen que juga un rol menor en la patogènesi de la malaltia.
L'abundant replicació i necrosi observada als macròfags en diversos òrgans condueix a la presència de nombrosos virions lliures al teixit intersticial. Això, juntament amb la destrucció de les cèl·lules diana del VPPA en aquestes àrees, afavoreix la infecció d'altres poblacions de cèl·lules durant fases més tardanes de la malaltia.
Les partícules víriques es poden observar als limfòcits i plaquetes com a conseqüència de la replicació del virus als megacariòcits. Aquests elements actuen com a vehicles passius per a la dispersió del virus per tot el cos, ja que tenen una funció similar als eritròcits, però només esdevé evident a les fases més avançades de la malaltia.[20]
Degut a l'absència d'anticossos neutralitzants, la virèmia persisteix durant molt temps, en alguns casos, fins a mesos.[19]
El virus de la pesta porcina africana es dirigeix principalment cap a les cèl·lules del llinatge mieloide, especialment els monòcits, els macròfags i les cèl·lules dendrítiques, que són les cèl·lules presentadores d'antígens professionals (APC). Aquestes cèl·lules detecten patògens associats a patrons moleculars (PAMPs) a través de la seva gamma de receptors de reconeixement de patrons (PRRs), com per exemple, els receptors tipus Toll (TLRs), que inicien la resposta immune, secretant citocines i quimiocines i presentant antígens per fagocitosi.[21]
Tant els macròfags infectats com els no infectats mostren canvis morfològics indicatius de l'activació fagocítica, caracteritzada per un increment en la mida de la cèl·lula, la proliferació lisosomal i la presència de restes cel·lulars fagocitades.
Tot i la replicació del virus als macròfags i la seva posterior necrosi, hi ha un augment en el nombre total de macròfags als òrgans en els que es produeix la replicació. Aquest increment es troba associat a una millora de l'activitat secretora dels macròfags.
La necrosi intensa de macròfags només ocorre a l'última fase de la malaltia, quan les lesions característiques de la PPA són ja evidents i els mecanismes patogènics involucrats ja han estat activats.
Els primers signes de febre i l'augment de TNF-α i IL-1 als nivells sèrics apareixen 1 o 2 dies després de la infecció, coincidint amb una elevada expressió de citocines als òrgans limfoides. Això indica que l'inici de la febre i l'augment de la producció de citocines en l'etapa inicial de la malaltia aguda estan lligades a l'activació de diferents poblacions de macròfags a la melsa i als ganglis limfàtics (principalment), i de les cèl·lules de Kupffer del fetge, que també mostren l'expressió d'IL-6 i provoquen la síntesi de proteïnes de fase aguda.
Els macròfags són responsables dels canvis observats als nivells d'IL-8 i d'IL-10:
Les cèl·lules natural killer (NK) juguen un paper molt important en la lluita en contra de les infeccions virals, ja que ataquen i destrueixen de forma directa les cèl·lules infectades pels virus i produeixen citocines (com per exemple, l'interferó γ) i quimiocines. Les cèl·lules NK també interaccionen amb altres limfòcits, millorant la funció de les cèl·lules dendrítiques i induint la seva maduració. A canvi, les cèl·lules dendrítiques augmenten l'activitat de les cèl·lules NK, que també es veu augmentada pels interferons de tipus I secretats per les cèl·lules infectades.
Estudis recents indiquen que les cèl·lules NK tenen un paper important a les respostes antivirals. Les cèl·lules NK són presents en el porc, i s'han descrit com a perforina +CD3+CD4−CD5±CD6−CD8+CD11b+CD16+. Tot i que encara no s'han reportat detalls sobre la naturalesa funcional de les cèl·lules natural killer dels porcs, els limfòcits de porcs proliferen i produeixen IFN γ quan són co-cultivats amb α-galatosylceramida, un estimulador específic de cèl·lules NK.
Es creu que les cèl·lules NK podrien estar involucrades en la producció de IFN γ després de la infecció amb el VPPA. Tot i així, l'elucidació de la funció de les cèl·lules NK en la resposta immune del VPPA requereix més investigació.[21]
L'interferó γ (IFN γ), originalment era anomenat factor d'activació dels macròfags, ja que regula a l'alça les funcions dels macròfags, incloent el processament i la presentació d'antígens. Encara que diferents tipus de cèl·lules secreten IFN γ, els principals productors són les cèl·lules T activades i les cèl·lules NK.
L'activació dels macròfags per acció de l'IFN γ augmenta l'activitat i les respostes pro-inflamatòries antimicrobianes directes, com la producció de citocines i quimiocines, i promou la producció d'IFN γ al lloc de la inflamació pels limfòcits reclutats, com ara les cèl·lules NK.
Com que el virus de la pesta porcina africana es dirigeix principalment a les cèl·lules presentadores professionals (macròfags, cèl·lules dendrítiques, ...), l'IFN γ pot tenir un impacte directe en les interaccions entre el VPPA i les cèl·lules hostatgeres, especialment durant les primeres etapes de la infecció pel virus.[21]
Cal sospitar de pesta porcina africana quan una síndrome molt infecciosa provoca entre un 95 i 100% de mortalitat en porcs de totes les edats amb els signes clínics de la pesta porcina. Les formes més lleus de la malaltia poden ser més difícils de diagnosticar.
En un diagnòstic post-mortem, trobarem múltiples hemorràgies, petèquies als ronyons, nòduls limfàtics hemorràgics (especialment els hepàtics, en casos crònics o salvatges), i infarts esplènics. També cal buscar la confirmació de laboratori. En els avortaments provocats per la pesta porcina africana, és més fàcil demostrar-la en la truja que no pas en el fetus. La placenta és un dels millors productes de l'avortament per al diagnòstic.[22]
És necessari establir un diagnòstic precoç i ràpid per aquesta malaltia per tal de poder eliminar focus el més ràpid possible, evitar la seva difusió i minimitzar les pèrdues. Hi ha diverses maneres de realitzar un diagnòstic per aquesta patologia:[23]
És aquell que valora els símptomes clínics de la malaltia, en aquest cas apareixen al tercer o quart dia de la patologia. Aquests signes van seguits d'una davallada de la temperatura abans de la mort. Inicialment s'observa anorèxia, tristesa i una descoordinació de moviments, per aquest fet, els animals solen estar la majoria del temps estirats de cúbit-lateral a terra i si s'aixequen es comprova la debilitat o falta de moviment en les extremitats posteriors. En les següents 12 o 24 hores de la malaltia, es poden observar exantemes cutanis com a conseqüència de les alteracions circulatòries i vasculars. Aquestes taques solen aparèixer a les orelles principalment, però també a les parets abdominals, a les natges i a la base de la cua. També poden aparèixer petèquies. També pot generar hemorràgies de les mucoses, alteracions en l'aparell digestiu i/o en el respiratori.[5]
S'utilitzen per verificar el diagnòstic clínic mitjançant l'observació de diferents òrgans diana. Les més característiques de la Pesta Porcina Africana són:[5]
Per tant, per portar a terme aquesta proves el més utilitzat són tècniques basades en la immunofluorescència directa, complementades amb la indirecta, de la melsa, ganglis limfàtics, fetge, ronyó, tonsil·les, entre altres, a partir de sèrum o exsudats per poder detectar anticossos. En el cas que nombre de mostres sigui molt elevat, una tècnica més efectiva, per la qual es substitueix és el ELISA.
Aquests dos tipus de diagnòstic presenten l'inconvenient de la similitud entre els símptomes i les lesions entre la Pesta Porcina Africana i la pesta porcina clàssica.
Es sembren bacteris, principalment al fetge i a la melsa, que causen malalties similars en els porcs, per poder establir un diagnòstic diferencial. Un exemple d'aquest bacteris són Pasteurellas, Escherichias.[5]
En porcs hiperimmunitzats per la Pesta Porcina Africana, se'ls inoculen fluids infectats amb aquest virus de porcs morts per aquesta malaltia, per tal de poder determinar si és aquesta o no la malaltia, és a dir, si el porc immunitzat contra aquesta mor, significarà que no és la Pesta Porcina Africana la causant de la mort. És un mètode segur i efectiu, però és costós, perquè obliga a disposar d'instal·lacions, personal i de diversos porcs que han de morir d'una malaltia lenta i dolorosa.[5]
En aquest cas, la millor opció seria portar a terme una combinació de tests que han d'incloure la detecció del genoma viral mitjançant una PCR, la detecció de l'antigen del virus a través de proves com ELISA o proves de fluorescència per anticossos, i l'aïllament del virus. Els països on aquest virus es troba present, generalment, són països en desenvolupament, on les proves que s'utilitzen són ELISA i les de fluorescència perquè són les més barates, però també són menys sensibles.[5][7][24][25]
Es pot aïllar de sang i de teixits com la melsa, el fetge, nòduls limfàtics i tonsil·les. La tècnica més utilitzada és la d'hemadsorció.
L'hemadsorció és un tret característic del virus de la pesta porcina africana. Es va descobrir in vitro i posteriorment es va utilitzar per al diagnòstic. Als cultius cel·lulars, els eritròcits apareixen en una disposició tipus corona que envolta les cèl·lules infectades, mentre que in vivo, els eritròcits adquireixen forma de pera i envolten els macròfags i monòcits infectats.
Aquesta tècnica es basa en el fenomen d'atracció i fixació específica dels glòbuls vermells sobre els leucòcits transformats per la infecció del virus, expressant la proteïna hemaglutinina que permet aquesta adsorció. La hemadsorció és reversible, ja que després de produir la transformació de la cèl·lula, el virus provoca efectes citopàtics sobre la cèl·lula, és a dir, la lisi d'aquesta, i així es desfan els agregats. Aquesta és una tècnica molt eficaç, fiable i molt utilitzada, perquè permet diferenciar entre els virus de la Pesta Porcina Africana i la Clàssica, ja que el primer dóna positiu en la prova i el segon no. Actualment, s'han detectat soques d'aquest virus que no produeixen ni hemadsorció ni efectes citopàtics, per tant, que generen falsos negatius en aquesta prova. Un altre problema d'aquesta tècnica, és que es tarden alguns dies a obtenir els resultats, depenent de si la soca és més o menys virulenta, altrament dit, com més virulent és el virus, més ràpid posa de manifest aquesta propietat. Per aquests problemes, és millor comprovar-ho amb tècniques com la ELISA, la PCR o de fluorescència.
Aquest test es basa en la detecció microscòpica de l'antigen, per tant, és una prova directa. La majoria d'aquests antígens són intracel·lulars, i per això s'utilitza un fluorocrom associat a anticossos específics, que generen cossos d'intrusió o grànuls fluorescents en el citoplasma de la cèl·lules infectades. Amb aquesta tècnica es resol la identificació dels virus que no presenten hemadsorció. S'ha de tenir en compte, que en la fase aguda de la malaltia aquesta prova té molta sensibilitat, però en fases cròniques o subagudes en perd una part important.
Aquesta prova mostra la interacció antigen-anticòs amb una prova colorimètrica, per tant, a diferència de l'anterior, és una prova indirecta. La variant més utilitzada s'anomena “Sandwitch ELISA”. Els avantatges d'aquest mètode són que és barat i que no necessita un equipament gaire complex, per tant, es pot utilitzar en la majoria de laboratoris. L'inconvenient més notable que presenta, és que només és recomanable utilitzar-la en fases agudes de la malaltia, ja que és quan hi ha més presència de virus i, per tant, la seva sensibilitat es veu afavorida, però mai serà tan elevada com la de la PCR.
Per realitzar aquestes proves s'han de seleccionar les àrees del genoma conservades entre els diferents genotips d'aquest virus, però suficientment diferents dels virus de soques relacionades amb aquesta, per evitar reaccions creuades. Aquest fet ha portat a generar noves variants de la PCR que evitin les reaccions creuades amb altres virus que afecten al porc.
Aquesta tècnica permet detectar el genoma del virus en mostres de sang, sèrum i òrgans. El petits fragments de DNA del virus els amplifica fins a quantitats detectables per la PCR. Aquesta prova és una alternativa més sensible, específica i ràpida a l'aïllament del virus, a més dóna positiu quan en un aïllament el virus no seria detectat. També és capaç de detectar els 22 diferents genotips coneguts, els virus que no produeixen hemadsorció i és capaç de detectar-los en estats molt inicials de la infecció o en baixes quantitats d'aquests antígens. Un avantatge molt important d'aquesta prova és que es pot utilitzar amb mostres inactivades o degenerades, per tant, pot treballar amb mostres que no es poden utilitzar en les proves d'aïllament, però la seva extremada sensibilitat fa que, en el cas que hi hagi hagut contaminació, doni falsos positius. Només donarà falsos negatius en presència d'inhibidors o àcids nucleics danyats si es treballa amb mostres degradades. És més barata i fàcil de portar a terme que la PCR a temps real, per tant, es pot portar a terme en laboratoris menys preparats.
Té les mateixes característiques que una prova normal, però amb millores. Aquesta tècnica augmenta la rapidesa, la sensibilitat, redueix les possibilitats de contaminació perquè és un sistema tancat i permet quantificar el resultat. Un altre avantatge és que cada cop és més automàtica. Es pot utilitzar amb proves amb oligonucleòtids i també pot donar lectures fluorescents. Aquesta prova és considerada com la millor i més eficient per fer aquest tipus de diagnòstics.
Aquesta prova es basa en els mateixos principis que la PCR convencional però s'utilitza per detectar virus diferents alhora, com per exemple, el virus de la Pesta Porcina Africana i el virus de la Pesta Porcina Clàssica, entre altres. Presenta dues fases, la primera amplifica el DNA de la mateixa manera que ho fa la PCR convencional, i la segona diferencia els genomes dels diferents virus a través de diversos estímuls. El desavantatge més notable d'aquesta prova és que té menys sensibilitat que les anteriors.
El seu funcionament és igual al de la PCR, però amb una diferència d'equipament, en comptes d'utilitzar el car equipament de termociclat de la PCR convencional, utilitza vapor d'aigua, per tant és una alternativa molt més barata a la PCR, que permet que es pugui utilitzar en laboratoris no tan especialitzats ni equipats, i en laboratoris mòbils. Aquesta prova encara s'ha de millorar en sensibilitat i especificitat.
Actualment no existeix cap vacuna per prevenir la pesta porcina africana. Els intents per immunitzar els animals utilitzant formulacions de vacuna preparades per mitjans convencionals i que comprenen extractes infectats, sobrenedants de leucòcits infectats de porc, virions purificats i inactivats, macròfags alveolars infectats, ... han fracassat en el seu objectiu d'induir immunitat protectora.[26]
Atès que els intents originals de vacunació contra el virus de la pesta porcina africana basats en virus atenuats, inactivats i vius no van ésser satisfactoris, alguns nous prototips de vacunes s'han provat experimentalment in vivo. Focalitzant-se en l'alteració de gens específics, com per exemple els gens que codifiquen les proteïnes implicades en l'evasió de la defensa de l'hoste, es poden obtenir resultats prometedors per al futur desenvolupament de vacunes atenuades recombinants en viu més segures.
Tot i que aquesta tecnologia s'ha utilitzat amb èxit per caracteritzar els factors de virulència del virus in vivo, encara no hi ha evidència de què l'ús d'aquests virus recombinants amb fins de vacuna, probablement degut a la virulència residual que conserven.[27]
Les cèl·lules T tenen un paper essencial en la protecció contra el virus de la PPA. Per tant, una vacuna ideal i efectiva per al futur no només ha d'induir anticossos neutralitzants, sinó que també ha d'induir respostes de cèl·lules T específiques contra el virus de la PPA.
En un intent d'assolir aquest objectiu, s'han dissenyat nombrosos prototips de vacunes utilitzant la immunització d'ADN com una eina per estimular i primar la resposta immune enfront del VPPA amb antígens del virus immunodominants.
Aquests dissenys han servit per entendre diferents conceptes:
A més de les seves capacitats de protecció, la identificació dels pèptids F3 i F6 ha permès l'exploració d'un fenomen immunològic molt interessant que podria tenir implicacions per als futurs dissenys de vacunes: la immunodominància.[21]
El virus de la pesta porcina africana (VPPA) és un virus d'ADN bicatenari, de mida gran, de simetria icosaèdrica i amb embolcall extern. Antigament, aquest virus es classificava com a membre de la família Iridoviridae i, actualment, és l'únic membre del nou gènere Asfivirus de la família Asfarviridae. El VPPA es transmet per artròpodes i causa la pesta porcina africana (PPA).
Das ASF-Virus (abgeleitet von englisch African swine fever virus, auch Afrikanisches Schweinepest-Virus) ist der Erreger der afrikanischen Schweinepest.
Das Virus wurde früher der Familie der Iridoviridae zugeordnet. 1984 wurde es dann in der internationalen Nomenklatur aus dieser Familie herausgetrennt und als einziges Virus der Familie der Asfarviridae (abgeleitet von African Swine Fever And Related Viruses) zugeordnet.
Das ASF-Virus ist ein behülltes, doppelsträngiges DNA-Virus, von dem bisher keine anderen serologischen Typen oder Subtypen bekannt sind. Es ist ein sehr hitze- und pH-Wert stabiler Erreger. Selbst stark säurehaltige Lösungen (bis pH-Wert 4) oder stark basische Verbindungen (bis pH-Wert 13) kann das Virus überleben. In Fleischwaren (z. B. Salami oder Schinken) bleibt der Erreger bis zu vier Monaten, im Knochenmark bzw. Schlachtkörper bis zu sieben Monaten infektiös. Durch Temperaturen über 75 °C und Gammastrahlung kann das Virus inaktiviert werden, Sonnenstrahlung und Fäulnisprozesse haben dagegen nur einen geringen Einfluss.
Das Virus vermehrt sich im Zytoplasma der Wirtszellen. Es besitzt eine stark lipidhaltige, äußere Virushülle und ist deshalb anfällig gegenüber Fettlösungsmitteln. Ein besonderer Virulenzfaktor ist, dass das Virus zwar eine Antikörperbildung im Körper hervorruft, jedoch keine das Virus neutralisierende Antikörper gebildet werden. Daher ist auch die Herstellung einer Vakzine heutzutage noch nicht möglich.
Das ASF-Virus kommt hauptsächlich in Afrika (Angola, Mosambik) vor. Daneben gilt vor allem Sardinien als enzootisch verseucht. Frühere gelegentliche, weltweite Seuchenausbrüche (Karibik, Südamerika, Mittelmeerinseln, Europa) konnten bisher getilgt werden. Nicht jedoch die aktuellen in Europa.
Wirtsspektrum sind Hausschweine, europäische Wildschweine, Warzenschweine (Phacochoerus aethiopicus), Buschschweine (Potamochoerus porcus) und Lederzecken (Ornithodorus spp.). China ist seit August 2018, Belgien seit September 2018 betroffen.[2] Ende Januar 2019 lag der Schwerpunkt des Vorkommens der Schweinepest im östlichen Mitteleuropa und Teilen Südosteuropas.
Am 22. Januar 2020 berichtete das Bundesministerium für Ernährung und Landwirtschaft, dass 12 km von der deutschen Grenze entfernt im polnischen Teil des Lausitzer Forsts ein infiziertes Wildschwein gefunden wurde.[3][4] Epidemiologische Untersuchungen ergaben jedoch im Nachhinein den Juli 2020 als Zeitraum für den Beginn westlich der deutsch-polnischen Grenze (siehe Afrikanische Schweinepest).[5] Auf dem Stand vom 13. November 2020 gab es schon 150 bestätigte Fälle von mit dem Virus infizierten Wildschweinen.[6]
Der Erreger hat eine hohe Umweltresistenz, er bleibt an Gegenständen und Körperteilen haften. Bei Raubtieren, die ein infiziertes Wildschwein erbeutet haben, kann der Erreger an ihrem Fang bleiben, so dass sie das Virus an folgenden Tagen an einem anderen getöteten Beutetier einer anderen Tierart hinterlassen.
Da Wildschweine gelegentlich Kadaver vertilgen, die von Raubtieren liegen gelassen wurden, können sie auf diese Weise das Virus aufnehmen.
Die extreme Umweltresistenz des Erregers ist der Schlüssel zum Verständnis und zur Entwicklung geeigneter Maßnahmen zur Bekämpfung,
sowohl in der Schweineproduktion als auch unter natürlichen Bedingungen, wenn die Infektion in Wildschweinpopulationen grassiert.[7]
Das ASF-Virus als Erreger der afrikanischen Schweinepest gilt als einer der gefährlichsten Krankheitserreger bei Schweinen. Sein Auftreten führt zu einer sich schnell ausbreitenden Epidemie mit großen ökonomischen Verlusten. Die Krankheit unterliegt daher in vielen Staaten besonderen Bekämpfungsmaßnahmen. Innerhalb der EU gibt es einheitliche Vorschriften zur Tilgung der Seuche, die dann von den einzelnen Mitgliedsstaaten entsprechend behördlich umgesetzt werden.
Zur Eindämmung dieser Krankheit werden die betroffenen Tiere gekeult.
Das ASF-Virus (abgeleitet von englisch African swine fever virus, auch Afrikanisches Schweinepest-Virus) ist der Erreger der afrikanischen Schweinepest.
Das Virus wurde früher der Familie der Iridoviridae zugeordnet. 1984 wurde es dann in der internationalen Nomenklatur aus dieser Familie herausgetrennt und als einziges Virus der Familie der Asfarviridae (abgeleitet von African Swine Fever And Related Viruses) zugeordnet.
Hui-chiu ti-jia̍t pēⁿ-to̍k (Eng-gí: African swine fever virus; ASFV) sī ín-khí Hui-chiu ti-jia̍t ê tì-pēⁿ goân. Pún khoán pēⁿ-to̍k ē tùi ti-á chō-sêng sí-bông-lu̍t chin koân ê chhut-hiat-jia̍t, chóng nā in thian-jiân ê kám-jiám tùi-siòng iû-ti (warthog), ē-châng-ti (bushpig), kiam Ornithodoros lūi sat-bó khì òe-tio̍h ê sî-chūn, sī bē chhut chèng-thâu.[1]
Hui-chiu ti-jia̍t pēⁿ-to̍k (Eng-gí: African swine fever virus; ASFV) sī ín-khí Hui-chiu ti-jia̍t ê tì-pēⁿ goân. Pún khoán pēⁿ-to̍k ē tùi ti-á chō-sêng sí-bông-lu̍t chin koân ê chhut-hiat-jia̍t, chóng nā in thian-jiân ê kám-jiám tùi-siòng iû-ti (warthog), ē-châng-ti (bushpig), kiam Ornithodoros lūi sat-bó khì òe-tio̍h ê sî-chūn, sī bē chhut chèng-thâu.
African swine fever virus (ASFV) is a large, double-stranded DNA virus in the Asfarviridae family.[1] It is the causative agent of African swine fever (ASF). The virus causes a hemorrhagic fever with high mortality rates in domestic pigs; some isolates can cause death of animals as quickly as a week after infection. It persistently infects its natural hosts, warthogs, bushpigs, and soft ticks of the genus Ornithodoros, which likely act as a vector, with no disease signs.[2] It does not cause disease in humans.[3][4] ASFV is endemic to sub-Saharan Africa and exists in the wild through a cycle of infection between ticks and wild pigs, bushpigs, and warthogs. The disease was first described after European settlers brought pigs into areas endemic with ASFV, and as such, is an example of an emerging infectious disease.
ASFV replicates in the cytoplasm of infected cells.[1] It is the only virus with a double-stranded DNA genome known to be transmitted by arthropods.[5]

ASFV is a large (175–215 nm),[6] icosahedral, double-stranded DNA virus with a linear genome of 189 kilobases containing more than 180 genes.[7] The number of genes differs slightly among different isolates of the virus.[8] ASFV has similarities to the other large DNA viruses, e.g., poxvirus, iridovirus, and mimivirus. In common with other viral hemorrhagic fevers, the main target cells for replication are those of monocyte, macrophage lineage. Entry of the virus into the host cell is receptor-mediated, but the precise mechanism of endocytosis is presently unclear.[9]
The virus encodes enzymes required for replication and transcription of its genome, including elements of a base excision repair system, structural proteins, and many proteins that are not essential for replication in cells, but instead have roles in virus survival and transmission in its hosts. Virus replication takes place in perinuclear factory areas. It is a highly orchestrated process with at least four stages of transcription—immediate-early, early, intermediate, and late. The majority of replication and assembly occurs in discrete, perinuclear regions of the cell called virus factories, and finally progeny virions are transported to the plasma membrane along microtubules where they bud out or are propelled away along actin projections to infect new cells. As the virus progresses through its lifecycle, most if not all of the host cell's organelles are modified, adapted, or in some cases destroyed.
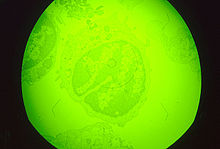
Assembly of the icosahedral capsid occurs on modified membranes from the endoplasmic reticulum. Products from proteolytically processed polyproteins form the core shell between the internal membrane and the nucleoprotein core. An additional outer membrane is gained as particles bud from the plasma membrane. The virus encodes proteins that inhibit signalling pathways in infected macrophages and thus modulate transcriptional activation of immune response genes. In addition, the virus encodes proteins which inhibit apoptosis of infected cells to facilitate production of progeny virions. Viral membrane proteins with similarity to cellular adhesion proteins modulate interaction of virus-infected cells and extracellular virions with host components.[1]
Based on sequence variation in the C-terminal region of the B646L gene encoding the major capsid protein p72, 22 ASFV genotypes (I–XXIII) have been identified.[10] All ASFV p72 genotypes have been circulating in eastern and southern Africa. Genotype I has been circulating in Europe, South America, the Caribbean, and western Africa. Genotype VIII is confined to four East African countries.
The virus is thought to be derived from a virus of soft tick (genus Ornithodoros) that infects wild swine, including giant forest hogs (Hylochoerus meinertzhageni), warthogs (Phacochoerus africanus), and bushpigs (Potamochoerus porcus).[11] In these wild hosts, infection is generally asymptomatic. This virus appears to have evolved around 1700 AD.
This date is corroborated by the historical record. Pigs were initially domesticated in North Africa and Eurasia.[12] They were introduced into southern Africa from Europe and the Far East by the Portuguese (300 years ago) and Chinese (600 years ago), respectively.[13] At the end of the 19th century, the extensive pig industry in the native region of ASFV (Kenya) started after massive losses of cattle due to a rinderpest outbreak. Pigs were imported on a massive scale for breeding by colonizers from Seychelles in 1904 and from England in 1905. Pig farming was free-range at that time. The first outbreak of ASF was reported in 1907.
ASFV has no known close relatives. It is the only species in the genus Asfivirus, family Asfarviridae, and order Asfuvirales. Each of these three taxa is at least partly named after ASFV.[14]
In the acute form of the disease caused by highly virulent strains, pigs may develop a high fever, but show no other noticeable symptoms for the first few days.[15] They then gradually lose their appetites and become depressed. In white-skinned pigs, the extremities turn blueish-purple and hemorrhages become apparent on the ears and abdomen. Groups of infected pigs lie huddled together shivering, breathing abnormally, and sometimes coughing. If forced to stand, they appear unsteady on their legs; this is called congenital tremor type A-I in newborn piglets.[16] Within a few days of infection, they enter a comatose state and then die. In pregnant sows, spontaneous abortions may occur.[17]
In milder infections, affected pigs lose weight, become thin, and develop signs of pneumonia, skin ulcers, and swollen joints.[18]
The clinical symptoms of ASFV infection are very similar to classical swine fever, and the two diseases normally have to be distinguished by laboratory diagnosis. This diagnosis is usually performed by an ELISA, real time PCR or isolation of the virus from either the blood, lymph nodes, spleen, or serum of an infected pig.[18]
The virus can be spread by ticks, but also by swine eating pork products that contain the virus. Biosecurity measures are essential for prevention and control of African swine fever. Disinfection procedures are an important asset of the mitigation phase. Laboratory tests have been conducted to assess the efficacy of chemical products and commercial disinfectants against African swine fever.[19] The National Pig Association, a UK industry body, states[20] that the virus can also be transmitted by direct or indirect contact with infected pigs, faeces or body fluids. As the virus may survive 11 days in pig faeces, and months or years in pork products, the association advises strict biosecurity measures for pig farms including a three-day quarantine on entering the UK, and avoiding both pigs and areas where wild boar are found.
Vietnam successfully produced the first vaccine against African swine fever on June 1, 2022.[21] In the United States, an experimental vaccine has been in development (since January 22, 2020) against the 2007 Georgia isolate currently circulating, which is attenuated by deletion of the viral I177L gene.[22] This experimental vaccine was licensed as a vaccine candidate as of January 3, 2023.[23][24]
The first outbreak was retrospectively recognized as having occurred in 1907 after ASF was first described in 1921 in Kenya.[25] The disease remained restricted to Africa until 1957, when it was reported in Lisbon, Portugal. A further outbreak occurred in Portugal in 1960. Subsequent to these initial introductions, the disease became established in the Iberian peninsula, and sporadic outbreaks occurred in France, Belgium, and other European countries during the 1980s. Both Spain and Portugal had managed to eradicate the disease by the mid-1990s through a slaughter policy.[26]
ASFV crossed the Atlantic Ocean, and outbreaks were reported in some Caribbean islands, including Hispaniola (Dominican Republic and Haiti).[27] Resultantly US Customs and Border Protection is on high alert to prevent any spread to the US, which would inflict billions of dollars of damage to the pork industry in the country.[27] Major outbreaks of ASF in Africa are regularly reported to the World Organisation for Animal Health (previously called L'office international des épizooties).
In 2018 the virus spread to Asia, affecting more than 10 percent of the total pig population in several countries, leading to severe economic losses in the pig sector.[28]
In 1971, an outbreak of the disease occurred in Cuba, resulting in the slaughter of 500,000 pigs to prevent a nationwide animal epidemic. The outbreak was labeled the "most alarming event" of 1971 by the United Nations Food and Agricultural Organization.
Six years after the event, the newspaper Newsday, citing untraceable sources,[29][30] claimed that anti-Castro saboteurs, with at least the tacit backing of U.S. Central Intelligence Agency officials, allegedly introduced African swine fever virus into Cuba six weeks before the outbreak in 1971, to destabilize the Cuban economy and encourage domestic opposition to Fidel Castro. The virus was allegedly delivered to the operatives from an army base in the Panama Canal Zone by an unnamed U.S. intelligence source.[31][32]
ASFV first occurred in Europe in 1957, when it was introduced in Portugal. From there, it spread to Spain and France. Although concerted efforts to eradicate ASFV were undertaken, such as widespread culling and the construction of modern farming facilities, the disease was only eradicated in the 1990s.[33]
In September 2018, an outbreak occurred in wild boars in southern Belgium.[34][35] Professional observers suspect that importation of wild boars from Eastern European countries by game hunters was the origin of the virus.[36] By 4 October, 32 wild boars had tested positive for the virus.[37] For control of the outbreak, 4,000 domestic pigs were slaughtered preventively in the Gaume region, and the forest was declared off-limits for recreation.
In September 2020, the German agriculture minister confirmed on a press conference that the African swine fever virus reached Germany. The virus was discovered on a wild boar carcass, which the test results confirmed all as positive results. The dead boar was located in the district of Spree-Neisse, Brandenburg, just a few kilometres from the Polish border. The dead animal had been there for quite a while according to the Friedrich-Loeffler Institute, which was the agency hired for testing. Following these events the German government tried to lobby China and other Asian countries to allow West German states to keep exporting to Asia, while barring their own eastern states from doing so; the Asian countries ultimately refused these proposals.[38][39]
In January 2022 an outbreak occurred in northern Italy, detected on some dead wild boars in Liguria and in Piedmont.[40]
An outbreak occurred at the beginning of 2007 in Georgia, and subsequently spread to Armenia, Azerbaijan, Iran, Russia, and Belarus, raising concerns that ASFV may spread further geographically and have negative economic effects on the swine industry.[26][41][42]
African swine fever had become endemic in the Russian Federation since spreading into the North Caucasus in November 2007, most likely through movements of infected wild boar from Georgia to Chechnya, said a 2013 report by the Food and Agriculture Organization, a United Nations agency.[43] The report showed how the disease had spread north from the Caucasus to other parts of the country where pig production was more concentrated the Central Federal District (home to 28.8% of Russia's pigs) and the Volga Federal District (with 25.4% of the national herd) and northwest towards Ukraine, Belarus, Poland and the Baltic nations. In Russia, the report added, the disease was 'on its way to becoming endemic in Tver oblast' (about 106 km north of Moscow—and about 500 km east of Russia's littoral neighbours on the Baltic. Among the vectors for the spread in Russia of African swine fever virus was the 'distribution' of 'infected pig products' outside affected (quarantined and trade restricted) areas, travelling large distances (thousands of kilometers) within the country.
"Wholesale buyers, particularly the military food supply system, hav[ing] been implicated multiple times in the illegal distribution of contaminated meat" were vectors for the virus's spread, said the Food and Agriculture Organization report—and evidence of that was "repeated outbreaks in Leningrad oblast".[44] The report warned that "countries immediately bordering the Russian Federation, particularly Ukraine, Moldova, Kazakhstan, and Latvia, are most vulnerable to [African swine fever] introduction and endemic establishment, largely because the biosecurity of their pig sector is predominantly low. Preventing the spread of [African swine fever] into Ukraine is particularly critical for the whole pig production sector in Europe. Given the worrisome developments in the Russian Federation, European countries have to be alert. They must be ready to prevent and to react effectively to [African swine fever] introductions into their territories for many years to come...". To stop the virus's spread, "the current scenario in the Russian Federation suggests that [prevention] should be particularly stressed at the often informal backyard level and should involve not just pig keepers, but all actors along the whole value chain—butchers, middlemen, slaughterhouses, etc. … They need to be aware of how to prevent and recognize the disease, and must understand the importance of reporting outbreaks to the national authorities … It is particularly important that [African swine fever]-free areas remain free by preventing the [re]introduction of the disease and by swiftly responding to it when it occurs".
Since around 2007 to August 31, 2018, 1367 cases of ASF of domestic pigs or wild pigs were reported by veterinary department of the Rosselkhoznadzor (Russian: Россельхознадзор), a Russian federal agency that supervises over agriculture, and state media.[45][46] According to official report the central and south districts were among most affected by the disease (with several occasions on the east).[45] Many regions effectively established local quarantines some of which was ended later.[47][48][49][50]
In August 2012, an outbreak of African swine fever was reported in Ukraine.[51]
In June 2013, an outbreak was reported in Belarus.[52]
In January 2014, authorities announced the presence of African swine fever in Lithuania and Poland,[53] in June 2014 in Latvia, and in July 2015 in Estonia.[54]
Estonia in July 2015 recorded its first case of African swine fever in farmed pigs in Valgamaa on the country's border with Latvia. Another case was reported same day in Viljandi county, which also borders Latvia. All the pigs were culled and their carcasses incinerated.[55] Less than a month later, almost 15,000 farmed pigs had been culled and the country was "struggling to get rid of hundreds of tons of carcasses". The death toll was "expected to rise".[56]
Latvia in January 2017 declared African swine fever emergency in relation to outbreaks in three regions, including a pig farm in Krimulda region, that resulted in a cull of around 5,000 sows and piglets by using gas.[57][58] In February, another massive pig cull was required, after an industrial-scale farm of the same company in Salaspils region was found infected, leading to a cull of about 10,000 pigs.[59]
In June 2017, the Czech Republic recorded its historically first case of African swine fever.[60] The veterinary administration of Zlin prevented the spread of the ASF infection by confining the contaminated zone via odor fences. Odor fences with a total length of 44.5 km were effective in keeping wild boar inside the health zone.
In 2018, Romania experienced a nationwide African swine fever pandemic, which prompted the slaughter of most farm pigs.[61]
In August 2018, authorities announced the first outbreak of African swine fever in Bulgaria.[62] By July 2019 five Bulgarian pig farms had had outbreaks of African swine fever.[63]
In July 2019, authorities announced the first outbreak of African swine fever in Slovakia.[64]
In February 2020, authorities announced the first outbreak of African swine fever in a restricted area of Northern Greece.[65]
In January 2021, Romania suffered again from a new breakout of the African swine fever virus that started in the Brăila County.[66]
In January 2022, ASF cases were reported in Northern Italy, Latvia and Hungary.[67][68][69]
In August 2018, China reported the first African swine fever outbreak in Liaoning province, which was also the first reported case in East Asia.[70] By September 1, 2018, the country had culled more than 38,000 hogs.[71] Since the week of September 10, 2018, China has blocked transports of live pigs and pig products in a large part of the country[72] to avoid spread beyond the 6 provinces where the virus was then confirmed. By the end of 2018, the outbreaks had been reported in 23 provinces and municipalities across China.[73] On April 25, 2019, the virus was reported to have spread to every region of China, as well as parts of Southeast Asia, including Cambodia, Laos, Thailand and Vietnam.[74] The Chinese pig population was reported to have declined by almost 100 million compared with the previous year, driving European pork prices to reach a six-year high.[75]
Ze Chen, Shan Gao, and co-workers from Nankai University detected ASFV in Dermacentor (hard ticks) from sheep and bovines using small RNA sequencing. This 235-bp segment had an identity of 99% to a 235-bp DNA segment of ASFV and contained three single nucleotide mutations (C38T, C76T and A108C). C38T, resulting in a single amino-acid mutation G66D, suggests the existence of a new ASFV strain, which is different from all reported ASFV strains in the NCBI Genbank database and the ASFV strain (GenBank: MH713612.1) reported in China in 2018.[76] In December 2019, China banned imports of pigs and wild boars from Indonesia because of African swine fever outbreaks that reached 392 on 17 December.[77]
On September 2019, South Korea confirmed a second case of African swine fever at a pig farm in Yeoncheon, where 4,700 pigs had been raised, a day after reporting its first-ever outbreak of the virus.[78] As of 31 October 2019, the virus has been detected in domestic pigs in nine places in Gyeonggi-do and five places in Incheon City. It was also confirmed in 18 wild boars from Gangwon-do and Gyeonggi-do, inside or near the Civilian Control Zone.[79]
The South Korean government set a buffer zone to separate affected areas from the rest of the country and instituted a compensation scheme for farms within 10 km (6.2 mi) of infected farms.[79]
Between December 2018 and June 2019, ten pig carcasses infected with ASF washed up on the shore in Kinmen (Quemoy) county. In June 2019, the government temporarily halted export of pigs and pork products from Kinmen county after two infected pig carcasses were discovered on the shore. Nearby farms were inspected by veterinarians and no live pigs tested positive for ASF.[80] On February 3, 2020, another infected pig carcass was discovered on the shore of Lieyu (Lesser Kinmen), bringing the total number of infected pig carcasses found on Kinmen county shores to eleven.[81][82] In April 2020, a twelfth pig carcass confirmed to be carrying African swine fever virus washed up on the shore of Lieyu (Lesser Kinmen). After testing, no outbreak of the disease was detected in the seven active hog farms on the island.[81][83] On May 29, China's Ministry of Agriculture and Rural Affairs said on Friday it had found a new outbreak of African swine fever near the city of Lanzhou in northwestern Gansu province.[84]
On April 9, 2019, a pig carcass with ASF was discovered on the shore of Nangan in the Matsu Islands (Lienchiang County) leading to a week-long ban on the transport of pigs from the county.[85]
The Philippines' Department of Agriculture started a probe in August 2019 regarding incidents of hog deaths in towns in Rizal and Bulacan for suspected African swine fever cases. The department ordered the culling of pigs within a 1 km (0.62 mi) radius of affected farms.[86]
The first case of African swine fever in the Philippines was confirmed on 9 September 2019 by the country's agriculture department.[87] The department sent 20 blood samples to the United Kingdom for testing, with 14 samples testing positive for African swine fever virus. At the time of the confirmation, though, the department has stated that the disease has not reached epidemic levels yet and is still assessing its severity.[86]
On 16 September 2019, the Bureau of Animal Industry's Director Ronnie Domingo confirmed that the status of the virus in the country is in an outbreak level in Rizal, Bulacan, Quezon City, and also confirmed across the provinces of Pampanga and Pangasinan in the end of September.
Vietnam confirmed its first case of African swine fever on 19 February 2019. As of 31 October 2019, all 63 provinces / municipalities have reported outbreaks and more than 5,700,000 pigs have been culled.[79]
The Vietnamese government acted to limit movement of pigs and pig products and implemented measures to prevent, promptly detect and strictly handle cases of smuggling, illegal transportation, and trafficking of animals and animal products—especially of pigs and pig products—into the country.[79]
ASF was reported on farms near the capital city, Dili in East Timor from 9 September 2019. On 30 September 2019, it was reported that 405 animals were killed or culled. [88] By the end of October 2019, a total of 100 outbreaks in smallholder pig farms had been recorded in Dili.[79]
In Sabah, Malaysia, outbreaks of ASF had been detected in domestic pigs by February 2021.[89] However, large numbers of dead wild pigs had been reported dead since January,[90] and over a hundred Bornean bearded pigs had been found dead as of March 2021; the Sabah Wildlife Department later stated that it was probably due to ASF.[91] Other Southeast Asian pig species are thought to also be vulnerable including the (Sulawesi) Celebes warty pig.[92]
On 29 April 2020, India reported the first African Swine Fever disease outbreak in the state of Assam and Arunachal Pradesh. It has been said that the disease is being spread via transboundary transmission from China. According to the data available with the veterinary department, over 15,000 pigs has been recorded dead from the 9 affected districts so far in Assam viz. Golaghat, Majuli, Dibrugarh, Kamrup, Dhemaji, Biswanath, North Lakhimpur, Sivasagar, Jorhat. Sale and consumption of pork meat have been banned in the affected districts of Assam. On 4 July, the test results of certain pig carcass samples came in as a confirmation for African Swine Fever in Bokakhat subdivision of Golaghat. The pig mortality reached around 800 numbers in Bokakhat. It is suspected that the infection came into the region from Kamargaon which is located near Bokakhat.
The appearance of ASF outside Africa at about the same time as the emergence of AIDS led to some interest in whether the two were related, and a report appeared in The Lancet supporting this in 1986.[93] However, the realization that the human immunodeficiency virus (HIV) causes AIDS discredited any potential connection with ASF.
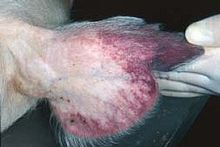 Reddening of the ears is a common sign of African swine fever in pigs.
Reddening of the ears is a common sign of African swine fever in pigs. African swine fever virus (ASFV) is a large, double-stranded DNA virus in the Asfarviridae family. It is the causative agent of African swine fever (ASF). The virus causes a hemorrhagic fever with high mortality rates in domestic pigs; some isolates can cause death of animals as quickly as a week after infection. It persistently infects its natural hosts, warthogs, bushpigs, and soft ticks of the genus Ornithodoros, which likely act as a vector, with no disease signs. It does not cause disease in humans. ASFV is endemic to sub-Saharan Africa and exists in the wild through a cycle of infection between ticks and wild pigs, bushpigs, and warthogs. The disease was first described after European settlers brought pigs into areas endemic with ASFV, and as such, is an example of an emerging infectious disease.
ASFV replicates in the cytoplasm of infected cells. It is the only virus with a double-stranded DNA genome known to be transmitted by arthropods.
Sigade Aafrika katku viirus (lüh. SAK viirus, inglise keeles African swine fever virus) on viiruseliik.[1]
Viiruse looduslikuks reservuaariks on harilikult pehme toesega puugid, kes nakatuvad viirust kandvatel sigalastel parasiteerides.
Sigade Aafrika katku viirus põhjustab sigalastel sigade Aafrika katku.
Viirus säilib nakatamisvõimelisena pikka aega (olenevalt temperatuurist ka aastaid) nii roojas, veres, spermas, pinnases, puit-, metall- kui ka kivipindadel.[4]
Sigade Aafrika katku viirus (lüh. SAK viirus, inglise keeles African swine fever virus) on viiruseliik.
Il virus della peste suina africana (ASFV, dall'inglese African swine fever virus) è una specie di virus a dsDNA, unica rappresentante dell'ordine Asfuvirales, appartenente al phylum Nucleocytoviricota.[1] Esso è l'agente causale della peste suina africana (ASF, dall'inglese African Swine Fever). Il virus causa una febbre emorragica con alti tassi di mortalità nei suini, mentre infetta in modo persistente i suoi ospiti naturali, i facoceri, i potamoceri e le zecche molli del genere Ornithodoros, senza segni di malattia.[2]
ASFV è un grosso virus a DNA a doppio filamento che replica nel citoplasma delle cellule infette.[3]
È anche il solo dsDNA virus che si trasmette tramite artropodi. Causa una malattia emorragica letale nei suini. Alcuni ceppi isolati possono causare la morte degli animali nell'arco di una settimana dall'infezione. In tutte le altre specie, il virus non comporta sintomi manifesti. ASFV è endemico nell'Africa subsahariana e tra i selvatici è sostenuta da un ciclo zecca-suino selvatico, facocero e potamocero. La malattia fu descritta per la prima volta dai coloni Europei che acquistarono suini dalle aree endemiche per ASFV e, in quanto tale, è un esempio di «malattia infettiva emergente».
ASFV è un grosso virus icosaedrico, con DNA lineare a doppio filamento, contenente almeno 150 geni. Il numero di geni differisce lievemente tra i diversi isolati virali.[4] ASFV ha similitudini con gli altri grossi virus a DNA, i Poxviridae, gli Iridoviridae e i Mimiviridae. In comune con altre febbri virali emorragiche, le cellule maggiormente usate per la replicazione sono i monociti e i macrofagi. L'ingresso del virus nella cellula ospite è mediato da recettori, ma il meccanismo di endocitosi preciso non è ancora chiaro.[5]
Il virus codifica per enzimi necessari alla replicazione e alla trascrizione del suo genoma, inclusi gli elementi del sistema di riparazione della scissione delle basi, le proteine strutturali e molte proteine non essenziali per la replicazione all'interno delle cellule, ma che invece hanno un ruolo nella sopravvivenza e trasmissione del virus ai suoi ospiti. La replicazione virale è un processo altamente organizzato con almeno 4 stadi trascrizionali — iniziale, precoce, intermedio e tardivo. La maggior parte degli eventi di replicazione e assemblamento avviene in regioni perinucleari separate, chiamate fabbriche virali, e alla fine i virioni ottenuti sono trasportati verso la membrana plasmatica sfruttando i microtubuli e gemmano o sono spinti da proiezioni di actina per infettare nuove cellule. Durante il ciclo del virus molti degli organelli della cellula ospite, se non tutti, vengono modificati, adattati o in certi casi distrutti.
L'assemblamento del capside icosaedrico si realizza sulle membrane modificate del reticolo endoplasmatico. I prodotti delle poliproteine del core processate proteoliticamente si pongono tra la membrana interna e il core nucleoproteico. Una membrana esterna addizionale è acquisita quando il virione gemma dalla membrana plasmatica. Il virus codifica proteine che inibiscono i percorsi di comunicazione nei macrofagi infetti e quindi modulano l'attivazione trascrizionale dei geni della risposta immunitaria. In aggiunta, il virus codifica per proteine che inibiscono l'apoptosi delle cellule infette per facilitare la produzione della progenie virionica. Le proteine di membrana simili alle molecole di adesione cellulare modulano le interazioni tra virus-cellula infetta e i virioni extracellulari con componenti dell'ospite.
Basandosi sulle variazioni di sequenze nella regione C-terminale del gene B646L, che codifica per la principale proteina del capside p72, sono stati identificati 22 genotipi di ASFV (I–XXIII).[6] Tutti i genotipi di ASFV p72 circolavano nell'Africa dell'est e del sud. Il genotipo I è circolato in Europa, Sud America, Caraibi e Africa occidentale. Il genotipo VIII è confinato a quattro Stati dell'Africa orientale.
Si pensa che questo virus sia derivato da un virus delle zecche molli (genere Ornithodoros) che ha infettato i suini selvatici, inclusi l'ilocero (Hylochoerus meinertzhageni), il facocero (Phacochoerus africanus) e il potamocero (Potamochoerus porcus).[7] In questi ospiti selvatici l'infezione è generalmente asintomatica. Pare che questo virus si sia sviluppato circa nel 1700.
Questa data è corroborata da documenti storici. I suini furono inizialmente addomesticati in Nord Africa ed Eurasia.[8] Furono introdotti in sud Africa dall'Europa e dall'Estremo Oriente dai Portoghesi (300 anni fa) e dai Cinesi (600 anni fa), rispettivamente.[9] Alla fine del XIX secolo l'allevamento estensivo del suino nella regione nativa di ASFV (Kenya) iniziò dopo una massiva perdita di bovini dovuta allo scoppio della peste bovina. I suini furono importati a livello massivo per l'allevamento dai colonizzatori delle Seychelles nel 1904 e inglesi nel 1905. Al tempo l'allevamento di suini era free-range. Il primo scoppio di ASF fu segnalato nel 1907.
Il virus della peste suina africana (ASFV, dall'inglese African swine fever virus) è una specie di virus a dsDNA, unica rappresentante dell'ordine Asfuvirales, appartenente al phylum Nucleocytoviricota. Esso è l'agente causale della peste suina africana (ASF, dall'inglese African Swine Fever). Il virus causa una febbre emorragica con alti tassi di mortalità nei suini, mentre infetta in modo persistente i suoi ospiti naturali, i facoceri, i potamoceri e le zecche molli del genere Ornithodoros, senza segni di malattia.
ASFV è un grosso virus a DNA a doppio filamento che replica nel citoplasma delle cellule infette.
È anche il solo dsDNA virus che si trasmette tramite artropodi. Causa una malattia emorragica letale nei suini. Alcuni ceppi isolati possono causare la morte degli animali nell'arco di una settimana dall'infezione. In tutte le altre specie, il virus non comporta sintomi manifesti. ASFV è endemico nell'Africa subsahariana e tra i selvatici è sostenuta da un ciclo zecca-suino selvatico, facocero e potamocero. La malattia fu descritta per la prima volta dai coloni Europei che acquistarono suini dalle aree endemiche per ASFV e, in quanto tale, è un esempio di «malattia infettiva emergente».
Virusul pestei porcine africane (ASFV) este agentul cauzator al pestei porcine africane. Virusul provoacă o febră hemoragică cu rate mari de mortalitate la porci, dar persistent infectează gazdele naturale cum ar fi porcii mistreți și Argasidele din genul Ornithodoros, fără semne de boală.[1] ASFV este un virus ADN dublu catenar care replică în citoplasma celulelor infectate. [2] ASFV infectează porci domestici, Phacochoerus și Potamochoerus larvatus, precum și căpușe moi (Ornithodoros), care este probabil să acționeze ca vector.[1]
ASFV este singurul virus cunoscut cu un genom DNA dublu catenar transmis de artropode. Virusul provoacă o boală hemoragică letală la porcii domestici. Unele cazuri izolate pot cauza moartea animalelor la o săptămână după infecție. La toate celelalte specii, virusul nu provoacă nici o boală evidentă. ASFV este endemică pentru Africa sub-sahariană și există în sălbăticie printr-un ciclu de infecție între căpușe și porci sălbatici, Phacochoerus și Potamochoerus larvatus. Boala a fost descrisă pentru prima dată după ce coloniștii europeni au adus porci în zone endemice cu ASFV și, ca atare, reprezintă un exemplu de „boală infecțioasă emergentă”.
Virusul pestei porcine africane (ASFV) este agentul cauzator al pestei porcine africane. Virusul provoacă o febră hemoragică cu rate mari de mortalitate la porci, dar persistent infectează gazdele naturale cum ar fi porcii mistreți și Argasidele din genul Ornithodoros, fără semne de boală. ASFV este un virus ADN dublu catenar care replică în citoplasma celulelor infectate. [2] ASFV infectează porci domestici, Phacochoerus și Potamochoerus larvatus, precum și căpușe moi (Ornithodoros), care este probabil să acționeze ca vector.
ASFV este singurul virus cunoscut cu un genom DNA dublu catenar transmis de artropode. Virusul provoacă o boală hemoragică letală la porcii domestici. Unele cazuri izolate pot cauza moartea animalelor la o săptămână după infecție. La toate celelalte specii, virusul nu provoacă nici o boală evidentă. ASFV este endemică pentru Africa sub-sahariană și există în sălbăticie printr-un ciclu de infecție între căpușe și porci sălbatici, Phacochoerus și Potamochoerus larvatus. Boala a fost descrisă pentru prima dată după ce coloniștii europeni au adus porci în zone endemice cu ASFV și, ca atare, reprezintă un exemplu de „boală infecțioasă emergentă”.
Virus dịch tả lợn châu Phi (African swine fever virus, viết tắt:ASFV) là tác nhân gây bệnh sốt lợn ở châu Phi (ASF). Virus gây sốt xuất huyết với tỷ lệ tử vong cao ở lợn, nhưng lây nhiễm liên tục vào vật chủ tự nhiên, Lợn rừng châu Phi, lợn lông rậm và ve mềm của chi Ornithodoros. Loài ve có khả năng hoạt động như một vật chủ trung gian không có dấu hiệu bệnh.[1]
ASFV là một virus DNA sợi kép lớn, nhân lên trong tế bào chất của các tế bào bị nhiễm bệnh.[2]
ASFV là virus duy nhất được biết đến với bộ gen DNA sợi kép được truyền bởi động vật chân đốt. Virus gây bệnh làm chết các con lợn nhà. Một số chủng phân lập có thể gây ra cái chết của động vật nhanh, trong vòng một tuần sau khi bị nhiễm bệnh. Trong tất cả các loài khác, virus gây ra không có bệnh rõ ràng. ASFV là loài đặc hữu của châu Phi cận Sahara và tồn tại trong tự nhiên thông qua một chu kỳ lây nhiễm từ ve và lợn rừng, lợn lông rậm và warthog. Bệnh này được mô tả lần đầu tiên sau khi những người định cư châu Âu đưa lợn vào khu vực lưu hành bệnh ASFV và đây là một ví dụ về bệnh truyền nhiễm mới nổi.
ASFV là một loại virus DNA sợi kép, lớn, có bộ gen tuyến tính chứa ít nhất 150 gen. Số lượng gen khác nhau một chút giữa các dòng virus khác nhau.[3] ASFV có những điểm tương đồng với các virus DNA lớn khác, ví dụ như poxvirus, iridovirus và mimivirus. Tương tự như các cơn sốt xuất huyết do virus khác, các tế bào đích chính để nhân lên là các tế bào đơn dòng, đại thực bào. Sự xâm nhập của virus vào tế bào chủ là qua trung gian thụ thể, nhưng cơ chế chính xác của endocytosis hiện chưa rõ ràng.[4]
Virus mã hóa các enzyme cần thiết để sao chép và sao chép bộ gen của nó, bao gồm các yếu tố của hệ thống sửa chữa cắt bỏ bazơ, protein cấu trúc và nhiều protein mà không cần thiết cho sự sao chép trong tế bào, nhưng thay vào đó có vai trò trong sự tồn tại và truyền virus của vật chủ. Sự nhân lên của virus diễn ra trong các khu vực hạt nhân. Đó là một quá trình được phối hợp chặt chẽ với ít nhất bốn giai đoạn phiên mã ngay lập tức - trước sớm, sớm, trung gian và muộn. Phần lớn sự sao chép và lắp ráp xảy ra ở các khu vực hạt nhân rời rạc của tế bào được gọi là các nhà máy virus và cuối cùng là virion tiền sinh được vận chuyển đến màng plasma dọc theo các vi ống nơi chúng nhú ra hoặc bị đẩy ra dọc theo các tế bào actin để lây nhiễm vào các tế bào mới. Khi virus tiến triển trong suốt vòng đời của nó, hầu hết nếu không phải tất cả các bào quan của tế bào chủ đều bị biến đổi, thích nghi hoặc, trong một số trường hợp, bị phá hủy.
Ở dạng cấp tính của bệnh gây ra bởi các chủng virus có độc lực cao, lợn có thể bị sốt cao, nhưng không có triệu chứng đáng chú ý nào khác trong vài ngày đầu.[5] Sau đó lợn dần mất cảm giác ngon miệng và trở nên chán nản. Ở lợn da trắng, tứ chi chuyển sang màu xanh tím và xuất huyết trở nên rõ ràng trên tai và bụng. Các nhóm lợn bị nhiễm bệnh nằm co ro cùng nhau run rẩy, thở bất thường và đôi khi ho. Nếu bị buộc phải đứng, chúng có vẻ đứng không được ổn định. Trong vài ngày bị nhiễm trùng, lợn rơi vào trạng thái hôn mê và sau đó chết. Ở lợn nái mang thai, sảy thai tự nhiên xảy ra. Nếu bị nhiễm trùng nhẹ, lợn bị nhiễm bệnh sẽ giảm cân, gầy và phát triển các dấu hiệu viêm phổi, loét da và sưng khớp.[6]
Các triệu chứng lâm sàng của nhiễm ASFV rất giống với sốt lợn cổ điển, và hai bệnh thường phải được phân biệt bằng chẩn đoán trong phòng thí nghiệm. Chẩn đoán này thường được thực hiện bằng ELISA hoặc phân lập virus từ máu, hạch bạch huyết, lá lách hoặc huyết thanh của lợn bị nhiễm bệnh.[6]
Vụ dịch đầu tiên được ghi nhận lại là đã xảy ra vào năm 1907 sau khi ASF được mô tả lần đầu tiên vào năm 1921 tại Kenya.[7] Bệnh vẫn được giới hạn ở châu Phi cho đến năm 1957 khi nó được báo cáo ở Lisbon, Bồ Đào Nha. Một vụ dịch nữa xảy ra ở Bồ Đào Nha vào năm 1960. Sau những vụ dịch ban đầu này, căn bệnh đã được hình thành ở bán đảo Iberia và những đợt bùng phát lẻ tẻ xảy ra ở Pháp, Bỉ và các nước châu Âu khác trong những năm 1980. Cả Tây Ban Nha và Bồ Đào Nha đã tìm cách tiêu diệt căn bệnh này vào giữa những năm 1990 thông qua chính sách giết mổ.[8]
Năm 1971, một vụ dịch này đã xảy ra ở Cuba, dẫn đến việc giết 500.000 con lợn để ngăn chặn dịch bệnh trên toàn quốc. Vụ dịch được coi là "sự kiện đáng báo động nhất" năm 1971 của Tổ chức Lương thực và Nông nghiệp Liên Hợp Quốc.
Sáu năm sau sự kiện, tờ Newsday, trích dẫn các nguồn không thể kiểm soát được,[9][10] tuyên bố rằng những kẻ phá hoại chống Castro, với ít nhất là sự ủng hộ ngầm của các quan chức Cơ quan Tình báo Trung ương Hoa Kỳ, được cho là đã đưa virus dịch tả lợn châu Phi vào Cuba sáu tuần trước khi dịch bùng phát vào năm 1971, để gây bất ổn nền kinh tế Cuba và khuyến khích phản đối trong nước đối với Fidel Castro. Virus này được cho là đã được chuyển đến các hợp tác xã từ một căn cứ quân sự ở Khu vực Kênh đào Panama bởi một nguồn tin tình báo Mỹ giấu tên.[11][12]
ASFV vượt Đại Tây Dương, và các vụ dịch đã được báo cáo ở một số đảo Caribê, bao gồm cả Hispaniola (Cộng hòa Dominican). Các vụ dịch lớn của ASF ở Châu Phi thường được báo cáo cho Tổ chức Thú y Thế giới (trước đây gọi là L'office International des épizooties).
ASFV lần đầu tiên xảy ra ở châu Âu vào năm 1957, khi nó được giới thiệu ở Bồ Đào Nha. Từ đó, nó lan sang Tây Ban Nha và Pháp. Mặc dù các nỗ lực phối hợp để tiêu diệt ASFV đã được thực hiện, chẳng hạn như giết động vật nhiễm bệnh số lượng lớn và xây dựng các cơ sở nông nghiệp hiện đại, căn bệnh này chỉ bị loại bỏ trong những năm 1990.[13]
Bên ngoài châu Phi, một vụ dịch xảy ra vào đầu năm 2007 tại Gruzia và sau đó lan sang Armenia, Azerbaijan, Iran, Nga và Belarus, gây lo ngại rằng ASFV có thể lan rộng hơn về mặt địa lý và có tác động kinh tế tiêu cực đến ngành chăn nuôi lợn.[8][14][15]
Vào tháng 8 năm 2012, dịch tả lợn ở châu Phi đã được báo cáo ở Ukraine.[16]
Vào tháng 6 năm 2013, một vụ dịch bùng phát đã được báo cáo ở Belarus.[17]
Sốt lợn châu Phi đã trở thành 'đặc hữu' ở Liên bang Nga kể từ khi lan sang Bắc Kavkaz 'vào tháng 11 năm 2007, rất có thể thông qua việc di chuyển của lợn rừng bị nhiễm bệnh từ Gruzia đến Chechnya, báo cáo năm 2013 của Tổ chức Lương thực và Nông nghiệp, một tổ chức thuộc Liên Hiệp Quốc cho hay.[18] Báo cáo cho thấy bệnh đã lây lan từ phía bắc từ vùng Kavkaz đến các vùng khác của Nga, nơi sản xuất lợn tập trung nhiều hơn ở Vùng Liên bang Trung tâm (nơi sinh sống của 28,8% lợn Nga) và Vùng Liên bang Volga (với 25,4% gia súc toàn quốc) và phía tây bắc về phía Ukraine, Belarus, Ba Lan và các quốc gia Baltic. Tại Nga, báo cáo cho biết thêm, căn bệnh này 'đang trở thành đặc hữu ở vùng Tver oblast' (khoảng 106 km về phía bắc Moscow Moscow và khoảng 500 km về phía đông của các nước láng giềng duyên hải của Nga trên biển Baltic. Trong số các trung gian truyền bệnh của sự lây lan ở Nga của virut dịch tả lợn châu Phi là 'phân phối' các 'sản phẩm lợn bị nhiễm bệnh' bên ngoài các khu vực bị ảnh hưởng (cách ly và buôn bán), trên một quãng đường lớn (hàng ngàn km) trong nước.
'Những người mua bán buôn, đặc biệt là hệ thống cung cấp thực phẩm quân sự, đã nhiều lần phân phối thịt bị nhiễm virus bất hợp pháp' là những hình thức lây lan của virus, báo cáo của Tổ chức Lương thực và Nông nghiệp cho biết. trong Leningrad oblast '.[19] Báo cáo cảnh báo rằng 'các quốc gia tiếp giáp với Liên bang Nga, đặc biệt là Ukraine, Moldova, Kazakhstan và Latvia, dễ bị nhiễm dịch bệnh tả lợn ở châu Phi, chủ yếu là do an toàn sinh học của ngành chăn nuôi lợn của họ hầu như là thấp. Ngăn chặn sự lây lan của [dịch tả lợn châu Phi] sang Ukraine đặc biệt quan trọng đối với toàn bộ ngành chăn nuôi lợn ở châu Âu. Trước những diễn biến đáng lo ngại ở Liên bang Nga, các nước châu Âu phải cảnh giác. Họ phải sẵn sàng ngăn chặn và phản ứng hiệu quả với những bùng phát dịch [tả lợn châu Phi] vào lãnh thổ của họ trong nhiều năm tới '... Để ngăn chặn sự lây lan của virut, 'kịch bản hiện tại ở Liên bang Nga cho rằng [phòng ngừa] cần được đặc biệt nhấn mạnh ở cấp độ sân sau thường không chính thức và không chỉ liên quan đến những người nuôi lợn, mà tất cả các tác nhân trong toàn bộ chuỗi giá trị, người trung gian, lò mổ, v.v... Họ cần lưu ý về cách phòng ngừa và nhận biết bệnh và phải hiểu tầm quan trọng của việc báo cáo dịch bệnh cho chính quyền quốc gia. Điều đặc biệt quan trọng là [các vùng chưa có dịch tả lợn ở Châu Phi] cần phải được bảo vệ bằng cách ngăn chặn dịch bùng phát tại đó và bằng cách nhanh chóng đáp ứng với nó khi nó xảy ra'.
Vào tháng 1 năm 2014, các nhà chức trách đã công bố sự hiện diện của dịch tả lợn châu Phi ở Litva và Ba Lan,[20] vào tháng 6 năm 2014 tại Latvia và vào tháng 7 năm 2015 tại Estonia.[21]
Estonia vào tháng 7 năm 2015 đã ghi nhận trường hợp đầu tiên của dịch lợn ở châu Phi ở lợn nuôi ở Valgamaa ở biên giới đất nước với Latvia. Một trường hợp khác đã được báo cáo cùng ngày tại quận Viljandi, cũng giáp với Latvia. Tất cả những con lợn đã bị giết và xác của chúng bị thiêu hủy.[22] Chưa đầy một tháng sau, gần 15.000 con lợn được nuôi đã bị giết và đất nước này đang 'vật lộn để thoát khỏi hàng trăm tấn lợn chết'. Số lợn chết 'dự kiến sẽ tăng'.[23]
Latvia vào tháng 1 năm 2017 đã tuyên bố tình trạng khẩn cấp sốt lợn ở châu Phi liên quan đến dịch ở ba khu vực, bao gồm một trang trại lợn ở vùng Krimulda, dẫn đến việc tiêu hủy khoảng 5.000 lợn nái và heo con bằng cách sử dụng khí đốt.[24][25] Vào tháng Hai, một đợt giết lợn khổng lồ khác đã được yêu cầu, sau khi một trang trại quy mô công nghiệp của cùng một công ty ở vùng Salaspils bị phát hiện nhiễm bệnh, dẫn đến việc giết bỏ khoảng 10.000 con lợn.[26]
Vào tháng 6 năm 2017, Cộng hòa Séc đã ghi nhận trường hợp đầu tiên trong lịch sử về bệnh dịch tả lợn ở châu Phi.[27] Cộng hòa Séc tại Zlin, thông qua một biện pháp của cơ quan thú y có liên quan, bằng cách đưa ra một quy định ngăn chặn sự lây lan của nhiễm trùng ASF bằng cách loại bỏ khu vực bị ô nhiễm qua hàng rào mùi. Hàng rào mùi với tổng chiều dài 44,5 km đã có thể giữ lợn rừng trong khu vực y tế.
Năm 2018, Romania đã trải qua một đại dịch tả lợn ở châu Phi trên toàn quốc, khiến cho hầu hết lợn nông trại bị giết bỏ.[28]
Vào tháng 8 năm 2018, các nhà chức trách thông báo đợt bùng phát đầu tiên của dịch tả lợn châu Phi tại Bulgaria.[29]
Vào tháng 9 năm 2018, một vụ dịch đã xảy ra ở lợn rừng ở miền Nam nước Bỉ.[30] Các nhà quan sát chuyên nghiệp nghi ngờ nhập khẩu lợn rừng từ các nước Đông Âu bởi các thợ săn giải trí là nguồn gốc của virus.[31] Đến ngày 4 tháng 10, 32 con lợn rừng đã thử nghiệm dương tính với virus này.[32] Để kiểm soát dịch bệnh, 4.000 con lợn trong nước đã được giết mổ phòng ngừa ở khu vực Gaume và khu rừng được tuyên bố là cấm hoạt động giải trí.
Từ khoảng năm 2007 đến ngày 31 tháng 8 năm 2018, 1367 trường hợp ASF của lợn nhà hoặc lợn hoang dã đã được bộ phận thú y của Rosselkhoznadzor (tiếng Nga: Россельхознадзор), một cơ quan liên bang Nga giám sát nông nghiệp) và truyền thông nhà nước, báo cáo.[33][34] Theo báo cáo chính thức của vùng trung tâm và phía nam liên bang Nga nằm trong số bị ảnh hưởng nhiều nhất bởi bệnh (với vài lần của vùng phía đông).[33] Nhiều khu vực thiết lập kiểm dịch địa phương một số trong đó đã được kết thúc sau đó.[35][36][37][38]
Vào tháng 8 năm 2018, Trung Quốc đã báo cáo dịch cúm lợn châu Phi đầu tiên bùng phát ở tỉnh Liêu Ninh, đây cũng là trường hợp được báo cáo đầu tiên ở Đông Á.[39] Tính đến ngày 1 tháng 9 năm 2018[cập nhật], đất nước đã tiêu hủy hơn 38.000 con lợn.[40] Kể từ tuần 10 tháng 9 năm 2018, Trung Quốc đã chặn vận chuyển lợn sống và các sản phẩm từ lợn ở một phần lớn của đất nước [41] để tránh lây lan thêm ra ngoài 6 tỉnh nơi hiện đang xác nhận virus. Vào cuối năm 2018, các vụ dịch đã được báo cáo ở 23 tỉnh và thành phố trên khắp Trung Quốc.[42]
Ze Chen và Shan Gao et. al. từ Đại học Nankai đã phát hiện virus dịch tả lợn ở châu Phi (ASFV) ở Dermómor (ve cứng) từ cừu và bò bằng cách sử dụng trình tự RNA nhỏ. Phân đoạn 235 bp này có nhận dạng 99% so với phân đoạn DNA 235 bp của ASFV và chứa ba đột biến nucleotide đơn (C38T, C76T và A108C). C38T, dẫn đến một đột biến axit amin G66D, cho thấy sự tồn tại của một chủng ASFV mới, khác với tất cả các chủng ASFV được báo cáo trong cơ sở dữ liệu NCBI GenBank và chủng ASFV (GenBank: MH713612.1) được báo cáo ở Trung Quốc vào năm 2018.[43]
Sự xuất hiện của ASF bên ngoài châu Phi cùng thời điểm với sự xuất hiện của AIDS đã dẫn đến một số quan tâm về việc liệu hai loại virus này có liên quan với nhau hay không, và một báo cáo xuất hiện trên tờ The Lancet ủng hộ điều này vào năm 1986.[44] Tuy nhiên, việc khám phá ra rằng virus gây suy giảm miễn dịch ở người (HIV) gây ra bệnh AIDS đã phủ định bất kỳ mối liên hệ tiềm năng nào của AIDS với ASF.
Vào tháng 9 năm 2018, sự bùng phát của dịch tả lợn châu Phi đã được ghi nhận ở Bỉ.[45]
Tính đến ngày 29 tháng 3 năm 2019, dịch tả lợn châu Phi đã lan ra 23 tỉnh tại Việt Nam: Hải Phòng, Thanh Hóa, Hà Nội, Hà Nam, Hải Dương, Thái Bình, Hưng Yên, Hòa Bình, Điện Biên, Thái Nguyên, Ninh Bình, Nam Định, Quảng Ninh, Bắc Kạn, Sơn La, Nghệ An, Lạng Sơn, Bắc Ninh, Thừa Thiên - Huế, Lai Châu, Bắc Giang, Vĩnh Phúc và Quảng Trị.[46]
Virus dịch tả lợn châu Phi (African swine fever virus, viết tắt:ASFV) là tác nhân gây bệnh sốt lợn ở châu Phi (ASF). Virus gây sốt xuất huyết với tỷ lệ tử vong cao ở lợn, nhưng lây nhiễm liên tục vào vật chủ tự nhiên, Lợn rừng châu Phi, lợn lông rậm và ve mềm của chi Ornithodoros. Loài ve có khả năng hoạt động như một vật chủ trung gian không có dấu hiệu bệnh.
ASFV là một virus DNA sợi kép lớn, nhân lên trong tế bào chất của các tế bào bị nhiễm bệnh.
ASFV là virus duy nhất được biết đến với bộ gen DNA sợi kép được truyền bởi động vật chân đốt. Virus gây bệnh làm chết các con lợn nhà. Một số chủng phân lập có thể gây ra cái chết của động vật nhanh, trong vòng một tuần sau khi bị nhiễm bệnh. Trong tất cả các loài khác, virus gây ra không có bệnh rõ ràng. ASFV là loài đặc hữu của châu Phi cận Sahara và tồn tại trong tự nhiên thông qua một chu kỳ lây nhiễm từ ve và lợn rừng, lợn lông rậm và warthog. Bệnh này được mô tả lần đầu tiên sau khi những người định cư châu Âu đưa lợn vào khu vực lưu hành bệnh ASFV và đây là một ví dụ về bệnh truyền nhiễm mới nổi.
アフリカ豚コレラウイルス(アフリカぶたコレラウイルス、African swine fever virus;ASFV)とはアフリカ豚コレラの病原体。アフリカ豚コレラウイルスは大型の二本鎖DNAウイルスでありウイルスの増殖は細胞質で行われる。アフリカ豚コレラウイルスはアスファウイルス科に属する唯一のウイルスである[1]。アフリカ豚コレラウイルスはブタ、イボイノシシ、カワイノシシ、軟ダニに感染する。アフリカ豚コレラウイルスはブタに致死性の出血性疾患を引き起こし、感染後1週間程度で死に至ることがある。ブタ以外の動物では目立った症状を引き起こさない。アフリカ豚コレラウイルスはサハラ以南のアフリカにおいてダニとブタ、イボイノシシ、カワイノシシの間で感染環を形成して存在している。アフリカ豚コレラウイルスによる症状は豚コレラウイルスによる症状と非常に類似しており、一般にその鑑別には実験室診断が必要である。
アフリカ豚コレラウイルス(アフリカぶたコレラウイルス、African swine fever virus;ASFV)とはアフリカ豚コレラの病原体。アフリカ豚コレラウイルスは大型の二本鎖DNAウイルスでありウイルスの増殖は細胞質で行われる。アフリカ豚コレラウイルスはアスファウイルス科に属する唯一のウイルスである。アフリカ豚コレラウイルスはブタ、イボイノシシ、カワイノシシ、軟ダニに感染する。アフリカ豚コレラウイルスはブタに致死性の出血性疾患を引き起こし、感染後1週間程度で死に至ることがある。ブタ以外の動物では目立った症状を引き起こさない。アフリカ豚コレラウイルスはサハラ以南のアフリカにおいてダニとブタ、イボイノシシ、カワイノシシの間で感染環を形成して存在している。アフリカ豚コレラウイルスによる症状は豚コレラウイルスによる症状と非常に類似しており、一般にその鑑別には実験室診断が必要である。
아프리카돼지열병바이러스(영어: African swine fever virus, ASFV)는 아프리카돼지열병(영어: African swine fever, ASF)의 원인 인자로서[1] 감염 세포의 세포질을 복제하는 거대 이중 나선 DNA 바이러스이다.[2] 이 바이러스는 돼지에게 폐사율이 높은 출혈열을 야기하면서도 질병 징후 없이 매개체 구실을 할 법한 자연적 숙주 돼지, 혹멧돼지, 강멧돼지, 연진드기과에 속하는 Ornithodoros 속을 지속적으로 감염시킨다.[1] 아프리카 돼지 열병 바이러스는 절지동물이 전파하면서 두가닥 DNA 유전자가 있는 유일한 바이러스로 알려져 있다. 이 바이러스는 돼지에게 치명적인 출혈열을 발생시킨다. 어떤 분리 바이러스는 감염 후 일주일 만에 빠르게 동물의 죽음을 야기할 수 있다. 이 바이러스는 다른 모든 종에게는 명백한 질병을 야기하지 않는다. 이 바이러스는 사하라 이남 아프리카에 풍토적이고, 진드기, 멧돼지, 강멧돼지, 혹멧돼지 사이의 감염 주기를 거쳐 야생 상태로 현존한다. 이 질병은 아프리카의 풍토적인 지역에서 돼지를 유입한 유럽 이주민에 의해 최초로 보고되었고, 그 결과 신종감염병의 표본이 되었다.
아프리카 돼지 콜레라 바이러스가 일으키는 돼지의 전염병. 고열, 청색증, 림프절과 내장의 출혈 따위를 증상으로 하며 치사율이 100%에 달한다. 멧돼지와 진드기 사이에 불현성의 감염 사이클이 형성되어 있으며, 호흡기를 통하여 또는 육제품을 매개로 돼지에게 전파된다.
아프리카 돼지 열병 바이러스는 최소 150개 유전자를 포함한 선형 유전체가 있는, 정이십면체의 거대 이중 나선 DNA 바이러스이다. 유전자의 수는 분리된 바이러스에 따라 조금씩 다르다.[3] 아프리카 돼지 열병 바이러스는 다른 거대 DNA 바이러스 즉, 폭스바이러스과(Poxviridae), 이리도바이러스속(Iridovirus), Mimivirus속과 유사점이 있다. 다른 출혈열과 마찬가지로 복제를 위한 주요 표적 세포는 단핵세포와 대식세포 계통에 속한다. 이 바이러스의 숙주 세포를 향한 침입은 수용체 매개 세포내섭취(Receptor-mediated endocytosis)이지만, 세포내섭취의 정확한 기전은 현재는 불분명하다.[4] 이 바이러스는 염기절제회복(Base excision repair), 구조 단백질(Structural proteins) 및 세포 복제에 필수적이진 않지만 그 대신 숙주 내 바이러스 생존과 전파에 구실이 있는 많은 단백질을 포함한 자신의 유전자의 복제와 전사에 필요한 효소를 암호화한다. 바이러스 복제는 핵 주위의 공장 지역에서 일어난다. 이 복제는 최소 네 전사 단계-급초기, 초기, 중기, 후기-가 있는 조직화된 처리 과정이다. 이 복제와 조립은 대다수 바이러스 공장이라고 불리는 세포의 핵 주위의 별개 지역에서 일어나고, 새로운 세포를 감염시키기 위해 액틴 투사에 따라 싹트거나 수송된 미세소관을 따라 자손 바이러스 입자가 세포막에 운반된다. 바이러스 수명 주기가 진행될수록 모든 숙주 세포의 세포소기관은 아니더라도 대부분은 변형되거나 각색되고 경우에 따라서는 파괴된다. 정이십면체의 캡시드 조립은 세포소에서 온 변형된 막 위에서 일어난다. 단백질 가수분해 처리된 종합 단백질에서 온 생성물은 내부 막과 핵단백질 핵 사이에 핵껍질을 형성한다. 더해진 외막은 입자가 세포막에서 싹틀 때 획득된다. 이 바이러스는 감염된 대식세포의 신호 경로를 억제하는 단백질을 암호화해서 면역 반응 유전자의 전사 활동을 변조한다. 게다가 이 바이러스는 자손 바이러스 입자의 생성을 용이하게 하기 위해 감염된 세포의 세포자살을 억제하는 단백질을 암호화한다. 세포부착분자와 유사한 바이러스막 단백질은 바이러스에 감염된 숙주 구성요소가 있는 세포외 바이러스 입자의 상호작용을 조절한다.[2]
주요 캡시드 단백질 p72를 암호화한 B646L 구조 단백질 유전자의 C-말단(C-terminal) 지역의 염기 서열 변이에 기초해서, 아프리카 돼지 열병 바이러스 22개 유전자형(I~XXIII)이 식별되었다.[5] 모든 아프리카 돼지 열병 바이러스의 p72 유전자형은 동부 및 남부 아프리카에서 유행해 오고 있다. 1형 유전자형(Genotype I)은 유럽, 남아메리카, 카리브해, 서아프리카에 유행해 오고 있고, 8형 유전자형(Genotype VIII)은 동아프리카의 4국가에 유행해 오고 있다.
이 바이러스는 숲멧돼지, 혹멧돼지, 덤불멧돼지를 포함한 멧돼지를 감염시킨 연진드기과의 바이러스에서 유래된 것으로 생각된다.[6] 이 야생 숙주에서 감염은 보통 무증상이다. 이 바이러스는 기원후 1700년경에 진화한 것으로 보인다. 이 연대는 역사 기록으로 입증된다. 돼지는 처음에 북아프리카와 유라시아에서 가축화되었다.[7] 돼지는 포르투갈인이 300년 전에 유럽에서 남아프리카로, 중국인이 600년 전에 근동에서 남아프리카로 각각 유입했다.[8] 19세기 말 아프리카 돼지 열병 바이러스의 태생 지역인 케냐 내의 대규모 양돈 산업 때문에 우역 발병으로 소의 대대적 손실이 시작됐다. 돼지는 세이셸 식민지 개척자가 1904년에 잉글랜드 식민지 개척자가, 1905년에 대규모로 수입한 것이다. 돼지 농장은 당시에 방목되었다. 아프리카 돼지 열병 바이러스의 최초 발병은 1907년에 보고된다.
고병원성 계통으로 야기된 이 질병의 급성 형태에서 돼지는 고열이 나타날 수 있지만 처음 며칠 동안은 다른 뚜렷한 증상은 보이지 않는다.[9] 그 다음에 돼지는 서서히 식욕을 잃고 우울해진다. 요크셔 돼지는 사지가 보라나 남색으로 변하고 귀와 배에 출혈이 명백해진다. 감염된 돼지 집단은 서로 꼭 붙어 몸을 떨고 비정상적 호흡을 하며 가끔 기침도 하게 된다. 억지로 서게 하면 다리가 비틀거린다. 감염 수일 안에 혼수 상태에 빠진 다음 죽는다. 임신한 암퇘지에게서는 자연 유산이 일어난다. 가벼운 감염에서는 영향 받는 돼지가 체중이 줄고 야위어지며, 폐렴, 궤양, 관절 삼출(Joint effusion)의 징후가 나타난다.[10] 사람의 건강에는 위협이 되지 않는다.
아프리카 돼지 열병은 병든 돼지와 건강한 돼지 간에 직접 전파될 수 있다. 이 전파는 감염된 돼지의 혈액, 조직, 분비물, 배설물을 통해 일어날 수 있다. 최근 감염된 돼지의 혈액은 아주 높은 수준의 아프리카 돼지 열병 바이러스를 지니고 있다. 회복된 동물도 잔류성 매개체가 될 수 있다. 이 바이러스는 죽을 때까지 신체 조직에 남는다. 이 바이러스가 나라마다 전파되는 주요 방법은 바이러스에 감염된 날음식 찌꺼기를 돼지에게 먹이는 것을 통해서이다. 이 바이러스는 신선한 돼지고기와 가공 돈육 제품에서 수개월간 살아남을 수 있다. 고기가 충분히 고온에서 쭉 요리됨을 확신할 수 있는 충분한 시간의 양으로 조리되는 한, 이 질병을 없앨 수 있다. 이 질병은 간접 수단을 통해서도 전파될 수 있다. 연진드기과가 이 바이러스를 옮기는 것으로 드러났고 아프리카에서는 연진드기과가 특히 멧돼지에서 가축화된 동물 사이의 주요 전파 방식으로 간주된다. 아프리카 돼지 열병 바이러스가 숙주 밖에서도 장시일 살아남을 수 있기 때문에, 농장 기구, 의복, 가축 사료와 같은 물건의 오염으로도 전파될 수 있다.[11]
아프리카 돼지 열병 바이러스의 임상 증상은 돼지 열병(Classical swine fever)과 아주 유사하고, 두 질병은 일반적으로 실험실 진단에서 변별되어야 한다. 이 진단은 보통 효소 결합 면역 침강 분석법 혹은 감염된 돼지의 혈액이나 림프절이나 비장이나 혈청에서 바이러스 분리로 수행된다.[10]
|isbn= 값 확인 필요: invalid character (도움말). 아프리카돼지열병바이러스(영어: African swine fever virus, ASFV)는 아프리카돼지열병(영어: African swine fever, ASF)의 원인 인자로서 감염 세포의 세포질을 복제하는 거대 이중 나선 DNA 바이러스이다. 이 바이러스는 돼지에게 폐사율이 높은 출혈열을 야기하면서도 질병 징후 없이 매개체 구실을 할 법한 자연적 숙주 돼지, 혹멧돼지, 강멧돼지, 연진드기과에 속하는 Ornithodoros 속을 지속적으로 감염시킨다. 아프리카 돼지 열병 바이러스는 절지동물이 전파하면서 두가닥 DNA 유전자가 있는 유일한 바이러스로 알려져 있다. 이 바이러스는 돼지에게 치명적인 출혈열을 발생시킨다. 어떤 분리 바이러스는 감염 후 일주일 만에 빠르게 동물의 죽음을 야기할 수 있다. 이 바이러스는 다른 모든 종에게는 명백한 질병을 야기하지 않는다. 이 바이러스는 사하라 이남 아프리카에 풍토적이고, 진드기, 멧돼지, 강멧돼지, 혹멧돼지 사이의 감염 주기를 거쳐 야생 상태로 현존한다. 이 질병은 아프리카의 풍토적인 지역에서 돼지를 유입한 유럽 이주민에 의해 최초로 보고되었고, 그 결과 신종감염병의 표본이 되었다.