en
names in breadcrumbs


Conservation efforts have made valuable land unavailable for human use. (Nowack, 1997; Sherr, 1996)
Predators include hawks and other raptors, cats and snakes. Golden lion tamarins have very distinct vocalizations, including about 17 specific calls used for things such as alarms, defense, etc. Their sounds include trilling for solo activity, clucking during foraging, whining for contact and long, song-like calls for vigilance. There is some sexual dimorphism in the calls.
(Sherr, 1996; Nowack 1997)
Perception Channels: tactile ; chemical
The golden lion tamarin is one of the rarest of all mammals in the wild, if not the rarest. It is certainly one of the most severely endangered of all primates in the world. There are only 400 left in the world, most on or near the Reserva Biologica de Poco des Antas in Rio de Janiero. The destruction of their habitat has accounted for their loss in numbers. The trees they live in are cut down for lumber, agriculture and housing. Large treeless areas prevent their spread.
There is hope because they have been bred successfully in captivity and this is continually raising their numbers. Reintroduction into the wild has been successful.
(Sherr, 1996)
IUCN Red List of Threatened Species: endangered
At one time, people captured and sold golden lion tamarins as pets. Their rapid decline in numbers has thwarted many people's desires for these exotic pets. They were also exploited in zoos and used in laboratories. (Nowack, 1997)
The golden lion tamarin is omnivorous (insectivorous and frugivorous). It eats spiders, snails, small lizards, eggs, small birds, fruits and vegetables. They eat insects using their long, slender fingers to probe into crevices in the tree bark. This technique is called "micromanipulation." It is uncommon that these tamarins will share food with others outside of their family members, but among the family members, some food sharing does take place. Juveniles, for example, playfully steal food from parents or siblings. (Sherr, 1996)
Animal Foods: birds; reptiles; eggs; insects; terrestrial non-insect arthropods; mollusks
Plant Foods: leaves; fruit
Primary Diet: omnivore
Lowland, coastal rain forest region in Southeast Brazil.
Biogeographic Regions: neotropical (Native )
They reside in dense forest that is entangled with many vines and has a high density of fruit. The climate is extremely humid. They occupy the closed canopy, often remaining 10-30 meters off the ground. They sleep in tree holes for protection from predators and warmth at night. (Sherr, 1996)
Terrestrial Biomes: rainforest
Golden lion tamarins live at least 15 years.
Average lifespan
Status: wild: 15 years.
Average lifespan
Sex: male
Status: captivity: 24.8 years.
Average lifespan
Sex: female
Status: captivity: 22.0 years.
The golden lion tamarin is between 200-366mm long (8-13in) with a tail length of between 315-400mm (12-15in). There is no sexual dimorphism. They have small, rounded heads adorned with a thick golden mane on the crown, cheeks, throat, ears and shoulders. Their bare faces are flat and have widely spaced nostrils. Their bodies are covered in long, soft silky hair with coloration ranging from pale golden to a rich reddish-gold. One interesting characteristic is that these tamarins have claws, not flattened fingernails. (Kleiman, 1981; Pearl, 1991; Sherr, 1996)
Other Physical Features: endothermic ; bilateral symmetry
Average mass: 654.5 g.
There is one breeding pair per group. The rearing of young is a cooperative effort by all in the group, although the majority is done by the father.
Mating System: monogamous ; cooperative breeder
Golden lion tamarins normally breed twice per year, between September and March. Females give birth to twins after a gestation of 130 to 135 days. The age of sexual maturity is 18 months for females and 24 months for males.
Breeding interval: Golden lion tamarins breed twice a year.
Breeding season: Golden lion tamarins breed between September and March, the warmest and wettest time of year.
Average number of offspring: 2.
Range gestation period: 130 to 135 days.
Average weaning age: 90 days.
Average age at sexual or reproductive maturity (female): 18 months.
Average age at sexual or reproductive maturity (male): 24 months.
Key Reproductive Features: iteroparous ; seasonal breeding ; gonochoric/gonochoristic/dioecious (sexes separate); sexual ; viviparous
Average birth mass: 55.3 g.
Average number of offspring: 2.
Average age at sexual or reproductive maturity (male)
Sex: male: 730 days.
Average age at sexual or reproductive maturity (female)
Sex: female: 547 days.
At birth, the golden lion tamarin is fully furred with eyes open. It clings to its mother for the first few weeks and nurses for a period of 90 days. At about week 5, it begins to expand its curiousity and experience things on its own. In some cases, it has been observed that a parent prefers to tend to an offspring of its own sex, but with experienced parents, it did not make a difference. (Nowack, 1997; Pearl, 1991; Sherr, 1996)
Parental Investment: precocial ; pre-fertilization (Provisioning, Protecting: Female); pre-hatching/birth (Provisioning: Female, Protecting: Female); pre-weaning/fledging (Provisioning: Female, Protecting: Male, Female); pre-independence (Protecting: Male, Female); post-independence association with parents; extended period of juvenile learning
Leontopithecus rosalia[1] a zo ur spesad primated e-touez kerentiad ar Cebidae.
 Penn Leontopithecus rosalia.
Penn Leontopithecus rosalia. 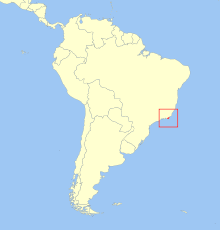
Kavet e vez e gevred Brazil ma reer "mico-leão-dourado" anezhañ e portugaleg.
Leontopithecus rosalia és una espècie de mico de la família dels cal·litríquids que viu als boscos costaners atlàntics del Brasil.
Leontopithecus rosalia és una espècie de mico de la família dels cal·litríquids que viu als boscos costaners atlàntics del Brasil.
Lvíček zlatý či lvíček malý (Leontopithecus rosalia) je malá opice z čeledi kosmanovitých (Callithrichidae), která obývá jen malé území jihovýchodní Brazílie (Mata Atlântica). Tento malý primát odolával již celá desetiletí průběžnému a tvrdému pronásledování, lovu, ale hlavně vybíjení jeho přirozeného životního prostředí, které není ani dnes ustáleno. To je důležitý důvod pro zapsání tohoto druhu do tzv. Červeného seznamu IUCN do kategorie „ohrožených druhů“. I přesto se v některých knižních zdrojích udává jako „kriticky ohrožený druh“, jelikož se odhaduje, že ve volné přírodě žije už přibližně jen 1000 a v zajetí 500 jedinců.
Lvíček zlatý má ještě tři pokrevní příbuzné (lvíček zlatohlavý, lvíček černý, lvíček černolící), ale právě lvíček zlatý je patrně nejznámější druh.
Pro lvíčka zlatého je nejtypičtější jeho zlatá a zlatohnědá srst, podle které dostala tato opička i svůj název. Jeho chlupy na tvářích jsou delší a tmavší a tvoří hřívu na vrcholu hlavy, lících a hrdle, což se stává pro lvíčka zlatého dalším charakteristickým znamením. V této husté srsti se ztrácejí i ušní boltce. I přesto, že má štíhlé nohy, má i dlouhé drápy, které jsou schopny zdatně škrábnout, a které se stávají nedocenitelnou pomůckou při jeho stromovém životě. Ačkoli je jeho ocas poměrně dlouhý, není chápavý. Výjimku ve zbarvení představují jenom konce jeho tlapek, obličej a občas i ocas, které mají barvu černou.
Jeho tělo měří na délku circa 335 milimetrů (13,2 cm, ale obvyklejší je 19-22 cm) a jeho ocas dorůstá 400 milimetrů (může dosáhnout i 36 cm, ale obvyklejší je 26-34 cm). Samci dosahují hmotnosti jen kolem 700 gramů v přírodě, ačkoli v zajetí dosahují i vyšší váhy. Těhotná samice může vážit nad 790 g, ale u netěhotné samice se hmotnost obvykleji pohybuje kolem 550 g.
Většina divokých populací žije na území biologické rezervace Poço das Antas, v chráněné oblasti v bažinatých lesích ve městě Rio de Janeiro. To je důležité území určené pro lvíčky zlaté, jen 2 % tohoto území představuje původní území rozšíření lvíčků. Mimoto, jeho existující lokalita má zničené životní podmínky a zemědělství; to má postupně za následek izolaci populací a plemenění zvířat mezi sebou, což postupně vede pravděpodobně k vyhynutí.
Početnost lvíčků zlatých poskytuje i baldachýn a nemálo ji komplikuje i narůstající početnost už tak četných predátorů. Jeho hlavními predátory jsou dravci, velké kočky a hadi. Baldachýn také poskytuje důležitý zdroj o potravě lvíčka; malý lvíček spoléhá na dešťovou vodu a na dostatek hmyzu u vodních nádrží, na různé plody a jiná menší zvířata obývající kůru na stromech.
Lvíček zlatý je velice mrštné zvíře, které se dokáže až neuvěřitelnou rychlostí pohybovat po stromech, kde hledá především masnou potravu jako hmyz, ještěrky, malé ptáky a jejich vejce, ale také různé ovoce. Aktivní je jak ve dne, tak v noci. Nikdy nežije samotářsky, vždy minimálně v párech, ale nejčastěji v malých skupinkách, které vydávají bohatou škálu nejrůznějších zvuků. Jsou to velice inteligentní zvířata, která dokáží před nebezpečím velice rychle uprchnout. Ačkoli žijí ve skupinách, může být jedna skupina rozprostřena i na několik desítek metrů a pokud se objeví nebezpečí a strážní opice vydá poplašný zvuk, lvíčci zmizí hluboko v korunách stromů.
Samice rodí nejčastěji jedno nebo dvě, velice vzácně i tři mláďata po 132 až 134 dnech březosti. Matce pomáhá i samec, kterému je samice jen občas půjčuje a to pod přísným dohledem. Nejprve je několik týdnů kojí, poté jim začne pomalu dávat i pevnou potravu (nejčastěji hmyz), kterou pečlivě rozmačká ve svých prstech.
V České republice se lvíček zlatý chová v těchto zoologických zahradách:
Lvíček zlatý či lvíček malý (Leontopithecus rosalia) je malá opice z čeledi kosmanovitých (Callithrichidae), která obývá jen malé území jihovýchodní Brazílie (Mata Atlântica). Tento malý primát odolával již celá desetiletí průběžnému a tvrdému pronásledování, lovu, ale hlavně vybíjení jeho přirozeného životního prostředí, které není ani dnes ustáleno. To je důležitý důvod pro zapsání tohoto druhu do tzv. Červeného seznamu IUCN do kategorie „ohrožených druhů“. I přesto se v některých knižních zdrojích udává jako „kriticky ohrožený druh“, jelikož se odhaduje, že ve volné přírodě žije už přibližně jen 1000 a v zajetí 500 jedinců.
Lvíček zlatý má ještě tři pokrevní příbuzné (lvíček zlatohlavý, lvíček černý, lvíček černolící), ale právě lvíček zlatý je patrně nejznámější druh.
Gylden løveabe (Leontopithecus rosalia), eller gylden løvetamarin, er en af de største egernaber. Den har sit navn efter den gyldne pels og ansigtsfarve og den karakteristiske "løvemanke" omkring hovedet.
Den bliver omkring mellem 20-34 cm lang, og kan vejer mellem 380 og 700 gram. Den kan blive helt op til 10 år gammel og lever af insekter, fugleæg, små pattedyr og frugt. Den bliver kønsmoden efter 16-20 måneder og er drægtig i 132-145 dage, hvorefter den føder 1-2 unger.
Gylden løveabe er dagsaktiv og kan ligesom egern bevæge sig i de tyndeste grene for at søge føde uden at falde ned.[3]
En gylden løveabes forsvarsposition er åben mund, buet ryg og en heftig stirren. Som de fleste andre aber bruger de meget tid på personlig hygiejne, hvor det for det meste er hannerne, der tager sig af hunnerne. Den lever i Brasiliens regnskov og er meget truet som følge af skovhugst. Bestanden var på et tidspunkt nede på kun 100 fritlevende eksemplarer. Zoologiske haver verden over begyndte da et avle og genudsætte dem med stor succes, så der nu er omkring 400 fritlevende individer, hvor langt størsteparten findes i Reserva Biologica de Poco des Antas i Rio de Janeiro.[4]
Gylden løveabe (Leontopithecus rosalia), eller gylden løvetamarin, er en af de største egernaber. Den har sit navn efter den gyldne pels og ansigtsfarve og den karakteristiske "løvemanke" omkring hovedet.
Den bliver omkring mellem 20-34 cm lang, og kan vejer mellem 380 og 700 gram. Den kan blive helt op til 10 år gammel og lever af insekter, fugleæg, små pattedyr og frugt. Den bliver kønsmoden efter 16-20 måneder og er drægtig i 132-145 dage, hvorefter den føder 1-2 unger.
Gylden løveabe er dagsaktiv og kan ligesom egern bevæge sig i de tyndeste grene for at søge føde uden at falde ned.
En gylden løveabes forsvarsposition er åben mund, buet ryg og en heftig stirren. Som de fleste andre aber bruger de meget tid på personlig hygiejne, hvor det for det meste er hannerne, der tager sig af hunnerne. Den lever i Brasiliens regnskov og er meget truet som følge af skovhugst. Bestanden var på et tidspunkt nede på kun 100 fritlevende eksemplarer. Zoologiske haver verden over begyndte da et avle og genudsætte dem med stor succes, så der nu er omkring 400 fritlevende individer, hvor langt størsteparten findes i Reserva Biologica de Poco des Antas i Rio de Janeiro.
Das Goldene Löwenäffchen (Leontopithecus rosalia), auch Goldgelbes Löwenäffchen genannt, ist eine Primatenart aus der Familie der Krallenaffen (Callitrichidae).
Goldene Löwenäffchen erreichen eine Kopfrumpflänge von 26 bis 33 Zentimetern, wozu noch ein 32 bis 40 Zentimeter langer Schwanz kommt. Ihr Gewicht beträgt etwa 570 bis 620 Gramm. Ihr seidiges Fell ist vorwiegend goldgelb gefärbt, die Vorderpfoten und der Schwanz können braun oder schwarz sein. Das dunkle, unbehaarte Gesicht ist von einer Mähne umgeben. Wie bei allen Krallenaffen enden die Finger und Zehen mit Ausnahme der ersten Zehe der Hinterpfoten in Krallen.
Goldene Löwenäffchen sind wie alle Löwenäffchen auf das südöstliche Brasilien beschränkt. Heute kommen sie nur mehr in einem kleinen Gebiet im Bundesstaat Rio de Janeiro vor, früher erstreckte sich ihr Verbreitungsgebiet auch auf Espírito Santo. Sie bewohnen tropische Regenwälder, meist unter 300 Metern Seehöhe.
Diese Primaten sind tagaktive Baumbewohner, in der Nacht schlafen sie in Baumhöhlen oder im Pflanzendickicht. Sie leben in Gruppen von zwei bis elf Tieren, es sind meist Familiengruppen, die aber mehrere Männchen und Weibchen enthalten können. Das Sozialverhalten innerhalb der Gruppe ist stark ausgeprägt, die gegenseitige Fellpflege und das Teilen der Nahrung spielen eine wichtige Rolle. Gruppen leben in festen Territorien von 30 bis 60 Hektar.
Goldene Löwenäffchen sind Allesfresser. Sie ernähren sich von Früchten, Blüten, Insekten, kleinen Wirbeltieren (beispielsweise Echsen), Nektar und Vogeleiern.
Innerhalb einer Gruppe pflanzt sich immer nur das ranghöchste Weibchen fort. Nach einer rund viermonatigen Tragzeit bringt das Weibchen meist Zwillinge zur Welt. Der Vater und die übrigen Gruppenmitglieder beteiligen sich intensiv an der Jungenaufzucht, sie tragen sie herum, beschäftigen sich mit ihnen und übergeben sie der Mutter nur zum Säugen.
Ab der fünften Lebenswoche werden die Jungtiere zunehmend selbstständiger, mit vier Monaten werden sie entwöhnt. Die Geschlechtsreife tritt mit 15 bis 20 Monaten ein, aufgrund der Sozialstruktur findet die erste Paarung allerdings selten vor dem 30. Lebensmonat statt. Die Lebenserwartung liegt bei etwa 14 Jahren.
Wie alle vier Arten der Löwenäffchen ist das Goldgelbe Löwenäffchen in seinem Bestand bedroht, da es nur in den südostbrasilianischen Regenwäldern vorkommt, die durch Rodungen stark in Mitleidenschaft gezogen wurden. Beim Goldenen Löwenäffchen zeigen allerdings Zucht- und Wiederaussiedlungsprogramme erste Erfolge. Die Gesamtpopulation wird auf über 1000 Tiere in freier Wildbahn geschätzt, davon stammt ein Drittel aus einem Wiederaussiedlungsprogramm im Poço-das-Antas-Naturpark. Rund 500 weitere Tiere werden in menschlicher Obhut gehalten. Doch ist ihr Verbreitungsgebiet zerstückelt und durch Zersiedlung stark eingeschränkt, so dass die IUCN die Art als stark gefährdet (endangered) listet.
In den Jahren 2014 und 2015 kam es zu Diebstählen von Goldenen Löwenäffchen aus den Zoos von Amersfoort (5 Tiere), Saint-Aignan-sur-Cher (7 Tiere) und Krefeld (3 Tiere), vermutlich um sie auf dem Schwarzmarkt zu verkaufen.[1][2][3]
Das Goldene Löwenäffchen (Leontopithecus rosalia), auch Goldgelbes Löwenäffchen genannt, ist eine Primatenart aus der Familie der Krallenaffen (Callitrichidae).
The golden lion tamarin (Leontopithecus rosalia, Portuguese: mico-leão-dourado [ˈmiku leˈɐ̃w dowˈɾadu], [liˈɐ̃w doˈɾadu]), also known as the golden marmoset, is a small New World monkey of the family Callitrichidae. Native to the Atlantic coastal forests of Brazil, the golden lion tamarin is an endangered species.[5] The range for wild individuals is spread across four places along southeastern Brazil, with a recent census estimating 3,200 individuals left in the wild[6] and a captive population maintaining about 490 individuals among 150 zoos.[3][7][8]
The golden lion tamarin gets its name from its bright reddish orange pelage and the extra long hairs around the face and ears which give it a distinctive mane.[9] Its face is dark and hairless. The bright orange fur of this species does not contain carotenoids, which commonly produce bright orange colors in nature.[10] The golden lion tamarin is the largest of the callitrichines. It is typically around 261 mm (10.3 in) and weighs around 620 g (1.37 lb). There is almost no size difference between males and females. As with all callitrichines, the golden lion tamarin has claw-like nails, instead of the flat nails found in other monkeys and apes, although callitrichines do have a flat nail on the big toe.[11] Tegulae enable tamarins to cling to the sides of tree trunks. It may also move quadrupedally along the small branches, whether through walking, running, leaping or bounding.[12] This gives it a locomotion more similar to squirrels than primates.
The Golden Lion Tamarin has a very limited distribution range, as over time they have lost all but 2%–5% of their original habitat in Brazil.[13] Today, this tamarin is confined to three small areas of the tropical rain forest in southeastern Brazil: Poço das Antas Biological Reserve, Fazenda União Biological Reserve, and private land through the Reintroduction Program.[7] The first population estimate made in 1972 approximated the count at between 400 and 500. By 1981 the population was reduced to less than 200. Surveys from as recently as 1995 suggested that there may have been at most only 400 golden lion tamarins left in the wild; but the population has since recovered to some 3200 in the wild. Tamarins live along the far southeast border of the country in the municipalities of Silva Jardim, Cabo Frio, Saquarema, and Araruama.[14] However, they have been successfully reintroduced to the municipalities of Rio das Ostras, Rio Bonito, and Casimiro de Abreu.[15] Tamarins live in coastal lowland forests less than 300 m (984 ft) above sea level.[16] They can be found in hilltop forests and swamp forests.
The golden lion tamarin is active for a maximum of 12 hours daily. It uses different sleeping dens each day.[17][18] By frequently moving their sleeping nests around, groups minimize the scent left behind, reducing the likelihood of predators finding them.[19] The first activities of the day are traveling and feeding on fruits. As the afternoon nears, tamarins focus more on insects. By late afternoon, they move to their night dens. Tamarin groups use hollow tree cavities, dense vines or epiphytes as sleeping sites. Sites that are between 11 and 15 m (36 and 49 ft) off the ground are preferred. The golden lion tamarin tends to be active earlier and retire later in the warmer, wetter times of the years as the days are longer.[17] During drier times, it forages for insects longer as they become scarcer.[17][18]
Golden lion tamarins are characterized by using manipulative foraging under tree barks and epiphytic bromeliads. Their sites of foraging are usually distributed around their home ranges, which are large territories (averaging 123 hectares) in which multiple foraging sites are located, to find sufficient resources over long periods of time. These areas are sufficient enough in size so that even if there is overlap in between the home range of two different groups, the interactions are minimal due to the distribution of the foraging sites (they spend 50% of their time in approximately 11% of their home range).[20]
The golden lion tamarin has a diverse, omnivorous diet consisting of fruits, flowers, nectar, bird eggs, insects and small vertebrates. They rely on microhabitats for foraging and other daily activities and tamarins will use bromeliads, palm crowns, palm leaf sheaths, woody crevices, lianas, vine tangles, tree bark, rotten logs, and leaf litters.[17][18] The golden lion tamarin uses its fingers to extract prey from crevices, under leaves, and in dense growth; a behavior known as micromanipulation.[21] It is made possible by elongated hands and fingers. Insects make up to 10–15% of its diet. Much of the rest is made of small, sweet, pulpy fruits. During the rainy season, the golden lion tamarin mainly eats fruit; however, during drier times, it must eat more of other foods like nectar and gums.[17] Small vertebrates are also consumed more at these times as insects become less abundant.
Golden lion tamarins are social and groups typically consist of 2-8 members. These groups usually consist of one breeding adult male and female but may also have 2–3 males and one female or the reverse.[22] Other members include subadults, juveniles and infants of either sex. These individuals are typically the offspring of the adults. When there is more than one breeding adult in a group, one is usually dominant over the other and this is maintained through aggressive behavior. The dominance relationship between males and females depends on longevity in the group. A newly immigrated male is subordinate to the resident adult female who inherited her rank from her mother.[23] Both males and females may leave their natal group at the age of four, however females may replace their mothers as the breeding adult, if they die, which will lead to the dispersal of the breeding male who is likely her father. This does not happen with males and their fathers. Dispersing males join groups with other males and remain in them until they find an opportunity to immigrate to a new group. The vast majority of recruits to groups are males.[24] A male may find an opportunity to enter into a group when the resident male dies or disappears. Males may also aggressively displace resident males from their group; this is usually done by two immigrant males who are likely brothers. When this happens, only one of the new males will be able to breed and will suppress the reproduction of the other. A resident male may also leave a vacancy when his daughter becomes the breeding female and he must disperse to avoid inbreeding.[25] Golden lion tamarins are highly territorial and groups will defend their home range boundaries and resources from other groups.[26]
Tamarins emit "whine" and "peep" calls, which are associated with alarm and alliances respectively.[27] "Clucks" are made during foraging trips or during aggressive encounters, whether directed at conspecifics or predators.[28] "Trills" are used to communicate over long distances to give away an individual's position. "Rasps" or "screeches" are usually associated with playful behavior. Tamarins communicate through chemicals marked throughout their territories. Reproductive males and females scent mark the most and their non-reproductive counterparts rarely do so. Dominant males use scent marking to show their social status and may suppress the reproductive abilities of the other males.
The mating system of the golden lion tamarin is largely monogamous. When there are two adult males in a group only one of them will mate with the female. There are cases of a male mating with two females, usually a mother and daughter.[22] Reproduction is seasonal and depends on rainfall. Mating is at its highest at the end of the rainy season between late March to mid-June and births peak during the September–February rains.[29] Females are sexually mature between the ages of 15–20 months but it isn't until they are 30 months old that they can reproduce.[28] Only dominant females can reproduce and will suppress the reproduction of the other females in the group.[30] Males may reach puberty by 28 months.[29] Tamarins have a four-month gestation period. Golden lion tamarin groups exhibit cooperative rearing of the infants. This is due to the fact that tamarins commonly give birth to twins and, to a lesser extent, triplets and quadruplets. A mother is not able to provide for her litter and needs the help of the other members of the group.[31] The younger members of the groups may lose breeding opportunities but they gain parental experience in helping to rear their younger siblings.[23] In their first 4 weeks, the infants are completely dependent on their mother for nursing and carrying. By week five, the infants spend less time on their mother’s back and begin to explore their surroundings. Young reach their juvenile stage at 17 weeks and will socialize other group members. The sub-adult phase is reached at 14 months, when a tamarin first displays adult behaviors.
The golden lion tamarin has a mutualistic interaction with 96 species of plants found in the Atlantic Forest. This interaction is based on seed dispersal and food sources for the tamarins. The tamarins show repeat visits to those plants with abundant resources. They tend to move around their territories, and therefore, seeds are dispersed to areas far from the parent shadow, which is ideal for germination. Their seed distribution is important to forest regeneration, and genetic variability and survival of endangered plant species.[32]
A study has shown that increased predation has caused significant decreases in the population numbers.[33] A survey conducted in 1992 found the number of wild population of golden lion tamarins to be 562 individuals in 109 groups. Currently, the average group size includes 3.6 to 5.7 individuals and densities from 0.39 groups/km to 2.35 groups/km.[34] These predatory attacks occur at the golden lion tamarin sleeping sites. The predators make those sleeping sites, which are mainly tree holes (about 63.6%), larger in order to attack the golden lion tamarins, sometimes wiping out the entire family. The preferred sleeping sites of most golden lion tamarins are tree holes in living trees next to other larger trees with a small percentage of canopy cover. These sleeping sites not only provide a place for sleep, but also offer protection and easy access to foraging sites. Most of the tree holes are lower to the ground, so they are easier to enter. Tree holes that are located in living trees are drier, warmer, and have a lower number of insects and therefore a decreased percentage of transmitted diseases. A smaller percentage of canopy coverage allows the golden lion tamarins to detect the predators faster, and being surrounded by other large trees allows them access to escape routes.[33] Due to degradation of their habitats, there are fewer trees that can support entire social groups and some have to resort to using bamboo (17.5%), vine tangles (9.6%), and bromeliads (4.7%) as a sleeping site, making them more susceptible to predators. Golden lion tamarins are known to use different den sites, but do not change sites often. They are more likely to reuse secure sites that will offer protection. However, the disadvantage of doing so is that predators are able to learn where these sites are located. Golden lion tamarins also scent mark their den holes, so they can quickly return to them in the afternoon time when predators are most active. While excessive scent makes it easier for golden lion tamarins to find their sleeping sites, it also helps predators locate their prey. Moreover, increased deforestation has decreased habitat space, providing predators easy access to their prey, causing a decline in the golden lion tamarin population.[35]

Threats to the golden lion tamarin population include illegal logging, poaching, mining, urbanization, deforestation, pet trading,[36] and infrastructure development and the introduction of alien species. In 1969, the number of individuals in the Atlantic Forest was found to have dropped to a low of 150 individuals.[37] In 1975 the golden lion tamarin was listed under Appendix I of CITES, given to animals threatened with extinction that may be or are being affected by trade.[38] The species was listed as Endangered by the IUCN in 1982,[3] and by 1984 the National Zoological Park in Washington, D.C. and the World Wide Fund for Nature, through the Golden Lion Tamarin Association, began a reintroduction programme from 140 zoos worldwide.[37] Despite the success of the project, the IUCN classification rose to Critically Endangered in 1996.[3] By 2003 the successful establishment of a new population at União Biological Reserve enabled downgrading the species to endangered,[39] but the IUCN warns that extreme habitat fragmentation from deforestation means the wild population has little potential for any further expansion.[3] In an attempt to curb the golden lion tamarin's precipitous decline, several conservation programs have been undertaken. The intent is to strengthen the wild population and maintain a secure captive population in zoos worldwide. The survival rate of re-introduced animals has been encouraging, but destruction of unprotected habitat continues.
Because of the extensive habitat loss of the golden lion tamarin, the wild population reached endangered status in the early 1980s. Beginning in 1983, there has been a huge effort on behalf of scientists and conservationists to introduce captive-born golden lion tamarins back into the wild. With the help of the Brazilian government, conservationists established the Poço das Antas Biological Reserve and the União Biological Reserve as sites for reintroduction. The goals of the reintroduction process include increasing the size as well as the genetic diversity of the wild population, increasing the available range to better encompass the historic range of the tamarins in Brazil, and widening the scope of public awareness and education programs.[40]
The first step of reintroduction begins with zoo free ranging programs, where tamarins have access to explore the entire zoo. However, they are kept on zoo grounds by the presence of a nest box, an ice box like container where their food is kept. When the tamarins are reintroduced in Poço das Antas Biological Reserve, they require a large amount of post-release training and veterinary care. For the first 6–18 months the reintroduced groups are monitored. Additionally, 1-2 tamarins from each group are radio collared to allow careful monitoring, and all reintroduced tamarins are tattooed and dye marked for easy identification.[40]

Secondly, in an effort to save the golden lion tamarins from extinction, some of the golden lion tamarins have been removed from small, isolated unsafe forests and placed into a larger, protected forest; specifically they were moved to União Biological Reserve and Poço das Antas reserve. This effort to move the golden lion tamarins into União Biological Reserve in Brazil began in 1991.[41] The golden lion tamarins faced the potential of getting new diseases that they had not been previously exposed to. Many were exposed to callitrichid hepatitis, and contracted the disease.[42]
Despite the challenge of illness, the forty-two translocated golden lion tamarins' population grew to over 200 in União Biological Reserve. The number of wild golden lion tamarins is now up in the thousands in all reserves and ranches combined in Brazil. These numbers were once down in the 200s in 1991. By 2025, the number of golden lion tamarins that are protected is projected to be greater than 2000.[41]
Golden lion tamarins are native to the Atlantic Forest of Brazil. Their original habitat was located from the southern part of the state of Rio de Janeiro to the southern part of the state of Espirito Santo. However, deforestation of Atlantic Forest for commercial purposes, predation, and capture of the golden lion tamarins for animal trade and sale as pets has limited their population to about five municipalities across Rio de Janeiro. Most of the population is now found in the Poco des Antas Biological Reserve in Rio de Janeiro.[34]
However, due to the deforestation and fragmentation of the Atlantic forest, their home ranges have decreased in size.[20] The decrease in size has been reported in terms of fragmentation, and today the forest consists of thousands of fragments equaling only 8% of its former size.[43] This directly affects their areas of foraging and subsequently, the amount of resources available.[20]
The habitat of the tamarins also affects their behavior and social interactions. For example, the type of trees present has a significant effect on the behavior of juvenile golden lion tamarins. Their juvenile behavior is characterized by social play between individuals of different ages and species. This is a key aspect of their social, cognitive and motor skill development, and it influences their behavior when facing competition and predators; how they play mirrors the way they act when facing predatory or competitive interactions. Social play is observed more in large branches (>10 cm) and vine tangles (4m above ground), which is considered safe for them, as they are less vulnerable to predators, compared to play in the dangerous areas including canopy branches and the forest floor. Therefore, deforestation affects the diversity in the forest and decreases the "safe" areas for play for the juvenile tamarins. As a result, play decreases and therefore the development of learned survivorship behaviors does as well. Also, if play is observed in the dangerous areas, the individuals are more exposed to predators, leading to a population decline; which resembles the effect of predation on their sleeping sites. The exposure to predation not only affects the juvenile tamarins but the adults as well, since it has been observed that play happens in the center of the group for protection of the young.[44]
Additionally, this deforestation and fragmentation also leads to demographic instabilities, and an increased probability of inbreeding, consequently leading to inbreeding depression and a population decline.[45] In the case of inbreeding, the problem lies in the increase of the isolated fragments where golden lion tamarins live. Inbreeding leads to low levels of genetic diversity and has a negative effect on survivorship; inbred offspring have a lower survivorship than non-inbred offspring. Fragmentation leads to a decline in dispersal and as a result, a decline in breeding with individuals of other groups. Consequently, inbreeding depression is observed in these populations.[46] With delay breeding, the decrease and shortage of territory puts pressure on golden lion tamarins to disperse in order to find necessary resources and areas suitable for their survival. However, dispersal is risky and requires a lot of energy that could have been used for reproduction instead.[47]
A 2016-2018 yellow fever epidemic in southeastern Brazil had a significant impact on the golden lion tamarin population, reducing it by 32% to approximately 2,516 individuals. The tamarin population faced increased losses in forest areas that were of a larger size, with fewer edge zones and greater connectivity, all of which could create conditions conducive to the presence and spread of mosquitoes that transmit yellow fever.[48] The impact of the outbreak was particularly devastating within the Poço das Antas Biological Reserve, with the population of around 400 tamarins dropping to only 32. The cause of this decline was attributed to human activities, such as the expansion of the BR-101 highway, which brings a constant flow of traffic into the area. Researchers noted that the rapid spread of the disease across Brazil, from north to south, was due to human mobility, as infected people carried the virus with them.[49]
In response to the epidemic, Brazilian scientists created a customized yellow fever vaccine specifically for golden lion tamarins. The vaccine campaign started in 2021 and had vaccinated over 300 tamarins by February 2023, with no reported adverse effects. The efficacy of the vaccine is similar to human vaccines, with 90-95% of retested monkeys showing immunity. By February 2023, the yellow fever outbreak had subsided, and the tamarin population had stabilized.[49]
The golden lion tamarin (Leontopithecus rosalia, Portuguese: mico-leão-dourado [ˈmiku leˈɐ̃w dowˈɾadu], [liˈɐ̃w doˈɾadu]), also known as the golden marmoset, is a small New World monkey of the family Callitrichidae. Native to the Atlantic coastal forests of Brazil, the golden lion tamarin is an endangered species. The range for wild individuals is spread across four places along southeastern Brazil, with a recent census estimating 3,200 individuals left in the wild and a captive population maintaining about 490 individuals among 150 zoos.
El tamarino león dorado, tití león dorado o tití leoncito (Leontopithecus rosalia) es una especie de primate platirrino de la familia Callitrichidae nativo de oriente de Brasil, donde quedan unos mil individuos en estado silvestre en bosques del litoral Atlántico al suroccidente de Río de Janeiro. Una parte de la población sobreviviente se encuentra en la Reserva Biológica de Poço das Antas. Hay además unos 500 en cautividad. Un pequeño mono del tamaño de una ardilla que vive en la selva atlántica del Brasil, está incluido en la lista de especies en grave peligro de extinción.
Se caracteriza por su pelaje abundante y sedoso de color dorado uniforme y su abundante melena que le vale el nombre de "león". El hocico carece de pelo. El cuerpo mide 34 a 40 cm de longitud y la cola entre 22 y 38 cm. pesan entre 300 y 700 g.
Son monógamos y constituyen grupos territoriales de 4 a 14 individuos, que tiene como líder a una pareja y viven dentro de unos 400 km². Maduran plenamente entre los 2 y 3 años de edad, pero a los 18 meses de edad ya pueden reproducirse. La gestación dura entre 126 y 130 días y generalmente culmina con el nacimiento de dos crías. Durante la primera semana de vida la hembra carga las crías, pero después los machos, lo hacen y las tareas de la crianza son compartidas por el grupo.
Se alimentan de frutos, flores, ranas, lagartijas, moluscos, insectos, resinas y néctar.
Esta especie está catalogada como especie en peligro de extinción desde 2003, sus mayores amenazas son la pérdida y fragmentación del bosque junto con la captura como animales domésticos y el comercio.
2008 - Especie en peligro de extinción
2003 – Especie en peligro de extinción
2003 – Especie en peligro de extinción (IUCN 2003)
2000 – Especie en peligro crítico de extinción
1996 – Especie en peligro crítico de extinción
1996 – Especie en peligro crítico de extinción (Baillie y Groombridge 1996)
1994 – Especie en peligro de extinción (Groombridge 1994)
1990 – Especie en peligro de extinción (IUCN 1990)
1988 – Especie en peligro de extinción (IUCN Conservation Monitoring Centre 1988)
1986 – Especie en peligro de extinción (IUCN Conservation Monitoring Centre 1986)
1982 – Especie en peligro de extinción (Thornback y Jenkins 1982)[2]
El tamarino león dorado, tití león dorado o tití leoncito (Leontopithecus rosalia) es una especie de primate platirrino de la familia Callitrichidae nativo de oriente de Brasil, donde quedan unos mil individuos en estado silvestre en bosques del litoral Atlántico al suroccidente de Río de Janeiro. Una parte de la población sobreviviente se encuentra en la Reserva Biológica de Poço das Antas. Hay además unos 500 en cautividad. Un pequeño mono del tamaño de una ardilla que vive en la selva atlántica del Brasil, está incluido en la lista de especies en grave peligro de extinción.
Lehoi-tamarin urrekara (Leontopithecus rosalia) Leontopithecus generoko animalia da. Primateen barruko Callitrichinae azpifamilia eta Cebidae familian sailkatuta dago
Lehoi-tamarin urrekara (Leontopithecus rosalia) Leontopithecus generoko animalia da. Primateen barruko Callitrichinae azpifamilia eta Cebidae familian sailkatuta dago
Kultaleijona-apina[2][3][4] eli kultaleijonatamariini (Leontopithecus rosalia) on Brasilian rannikkosademetsissä elävä Amerikan mantereen apinalaji. Laji on uhanalainen, sillä niitä elää luonnossa yli tuhat yksilöä ja vankeudessa viisisataa. Määrä kuitenkin on kasvanut tehokkaan suojeluhankkeen ansiosta, sillä vuonna 1980 kultaleijona-apinoita arveltiin olevan jäljellä vain noin sata yksilöä. Laji oli ennen suojelua suosittu lemmikkieläin. Nisäkäsnimistötoimikunta on ehdottanut, että lajin suomenkieliseksi nimeksi vaihdettaisiin kultatamariini.[2]
Kultaleijona-apinan voi tunnistaa hehkuvan punaisesta turkista. Laji on kokonsa puolesta pienimpiä apinalajeja: se painaa noin puoli kiloa, ja ruumiin pituus on 50–60 cm, josta hännän pituus 30–35 cm. Kultaleijona-apinan kaulaa ja päätä ympäröi suuri ja aaltoileva harja. Liikkeiltään laji on vikkelä, ja pitkän häntänsä avulla se ylläpitää tasapainoa.
Luonnossa lajia voi tavata Brasilian rannikon sademetsistä. Kultaleijona-apinat elävät yleensä alle kahdeksan yksilön laumoissa, joihin kuuluu täysi-ikäinen naaras ja koiras, niiden eri-ikäisiä poikasia ja muita sukulaisia.
Luonnossa lajin yleinen elinikä on noin 8–15 vuotta, mutta eläintarhoissa ne voivat elää lähes 30-vuotiaiksi.
Lajin luontaisia vihollisia ovat muun muassa petolinnut, käärmeet ja isot kissat. Kuten villieläimillä yleensä, elinalueiden ja metsien pirstoutuminen on luontaisia uhkia merkittävämpi.
Lajin tiineysaika kestää noin 126–130 päivää, ja usein naaras saa kaksoset. Naaras huolehtii poikasista ensimmäisten viikkojen ajan, minkä jälkeen päävastuun kasvattamisesta ottaa koiras. Vanhemmat jättävät poikaset omilleen noin 90 päivän iässä. Poikasten kuolleisuus on suuri; yli puolet poikasista kuolee ensimmäisen elinvuotensa aikana.
Kultaleijona-apina on kaikkiruokainen. Se syö pieniä hyönteisiä, pieniä selkärankaisia, hedelmiä sekä puiden erittämää mahlaa ja hartsia.
Kultaleijona-apinat viihtyvät hyvin tarhoissa ja lemmikkeinä, mikä osaltaan oli syynä niiden laajamittaiseen metsästämiseen. Eläintarhoissa elää noin 500 kultaleijonatamariinia. Myös Helsingin Korkeasaaren eläintarhassa on brasilialaisia kultaleijonatamariineja, jotka synnyttivät poikasia heinäkuussa 2010.[5]
Kultaleijona-apina eli kultaleijonatamariini (Leontopithecus rosalia) on Brasilian rannikkosademetsissä elävä Amerikan mantereen apinalaji. Laji on uhanalainen, sillä niitä elää luonnossa yli tuhat yksilöä ja vankeudessa viisisataa. Määrä kuitenkin on kasvanut tehokkaan suojeluhankkeen ansiosta, sillä vuonna 1980 kultaleijona-apinoita arveltiin olevan jäljellä vain noin sata yksilöä. Laji oli ennen suojelua suosittu lemmikkieläin. Nisäkäsnimistötoimikunta on ehdottanut, että lajin suomenkieliseksi nimeksi vaihdettaisiin kultatamariini.
Leontopithecus rosalia • Petit singe-lion, Singe-lion doré
Le Tamarin-lion doré[1],[2], Singe-lion doré[1] ou Petit singe-lion[2] (Leontopithecus rosalia) est une espèce de primate de la famille des Callitrichidae.
Golden lion tamarind. Mico-leão-dourado au Brésil.
On le trouve dans l'est du Brésil, au centre et au sud du littoral de l’État de Rio de Janeiro. Sur une aire totale à peine supérieure à 100 km2 recouvrant seulement quelques municipalités [essentiellement Saquarema, Araruama (Macaé de Cima), São Pedro da Aldeia et Cabo Frio sur le littoral, et juste au nord Silva Jardim, Aldea Velha, Casimiro de Abreu et Rio das Ostras dans le bassin du Rio São João. En 2006, il a été trouvé dans le PM de Taquara (municipalité de Duque de Caxias), qui constitue à ce jour la limite australe de l’espèce. Au XIXe siècle, cette espèce occupait aussi l’état d’Espírito Santo (au sud du Rio Doce) sur une aire totale de 14 000 km2.
Il vit dans la forêt tropicale côtière de la Mata Atlântica riche en broméliacées à une altitude comprise entre le niveau de la mer et 300 m d’altitude (une micropopulation a été observée à 550 m d’altitude dans la Serra do Mar) où la saison sèche de mai à juillet-août. Il affectionne la forêt primaire, s’accommode tant bien que mal de la forêt secondaire (comme à Poço das Antas) et ne survit pas dans les zones cultivées. Il doit subsister dans des forêts toujours plus dégradées et morcelées. Sympathie et association : en hiver dans la fazenda Rio Vermelho, il s’associe 65 % du temps avec l’ouistiti du Nordeste (Callithrix jacchus).
Sa fourrure est dorée, orangée, rougeâtre ou chamois. D’ordinaire, seules la face et les mains sont nues et sombres. Toutefois, certains spécimens présentent une croupe sombre ou une tache sombre sur le flanc ou un appendice caudal sombre (totalement ou bien seulement une ou deux sections de la queue nettement délimitées). En captivité, si la nourriture est pauvre en caroténoïdes, le pelage devient sombre. Les doigts sont fins et longs adaptés à la récolte d’insectes dans les anfractuosités ou sous l’humus (micromanipulation).
Les nouveau-nés ont un pelage doré pâle, plus clair que celui de l’adulte.
Corps : en moyenne 26 cm (de 20 à 33,6 cm). Queue : en moyenne 37 cm (de 31 à 40 cm). Poids : de 437 à 710 g pour les mâles et de 361 à 794 g pour les femelles. Le poids du mâle augmente en mai et décroît de 12 % en juin. Cerveau : 12,9 g. Rapport longueur bras/jambes (x100) : 86,7.
Le territoire mesure de 36 à 67 ha (d’après Dietz et al.). Il est défendu activement par des marquages olfactifs, des cris et des démonstrations visuelles.
12/km² (Poço das Antas). 6/km² (fazenda Rio Vermelho).
Quadrupède.
C'est un animal diurne. Arboricole, il descend parfois à terre.
Dans le parc zoologique de Sainte-Augustine (Floride), on l’a observé épouiller le dos d’un papegeai maillé (Deroptyus accipitrinus).
Il parcourt chaque jour 1,339 à 1,533 km (d’après Dietz et al.). Voyage entre 10 et 30 m au-dessus du sol et cherche les insectes plus bas entre 5 et 10 m. Tout juste éveillé, le mâle adulte grimpe à la cime pour y prendre un bain de soleil, bientôt suivi par le reste de la famille. Repas matinal. Après la sieste de midi sur un tronc oblique, les jeunes batifolent, multipliant les poursuites et les parties de catch. La mère repart alors en quête de nourriture, laissant à son compagnon la garde des jumeaux nouveau-nés. À la nuit tombante, après la rituelle séance d’épouillage, toute la famille réintègre son antre, le mâle rentrant en dernier tout en surveillant les environs. Le groupe dispose d’une vingtaine d’abris, mais seuls deux ou trois troncs sont régulièrement habités. Les trous doivent avoir au moins 10 cm de diamètre, souvent ceux de vieux arbres en décomposition, à l’abri des trombes d’eau et des prédateurs. Les grandes broméliacées de plus de 70 cm de large constituent d’autres sites nocturnes prisés.
C'est un animal frugivore, faunivore et exsudativore. Il n'hésite pas à descendre de son perchoir pour chasser aussi bien à terre que dans les arbres avec une prédilection pour les broméliacées, la couronne des palmiers et les feuilles de palmiers morts. Les proies sont localisées au toucher plutôt qu’à la vue (c'est l'inverse chez les ouistitis). Il fouille la litière de feuilles des palmiers, gratte l'écorce pourrie, inspecte les crevasses. Il se nourrit d'insectes (blattes, orthoptères, lépidoptères, larves de coléoptères), araignées (araignées-loups et mygales), vers de terre, escargots, lézards, grenouilles arboricoles, crapauds, œufs d'oiseau. L'alimentation végétale reste prédominante. Dans la RB d'União, il consomme cinquante-sept espèces de fruits d'au moins dix-sept familles, davantage de couleur jaune (40,3 %) que noire ou violette (28,1 %) ou rouge (14 %), avec une prédilection pour les graines oblongues, notamment des espèces des genres Cecropia, Tapirira, Rollinia, Pouteria, Passiflora, Miconia et Henriettea. À Poço das Ontas, une quarantaine d'espèces de plantes d’une vingtaine de familles différentes entrent dans son régime, les fruits (trente-huit espèces) venant loin devant les fleurs (trois espèces) et les exsudats (trois espèces). Pendant la saison sèche (mai à août), il absorbe ici des exsudats végétaux. On le voit mordre la base des lianes Machaerium pour provoquer un écoulement de sève. Boit dans le creux d'une branche en mettant la main à la bouche ou en lapant directement au cœur d'une broméliacée (plante-abreuvoir universelle pour les mammifères arboricoles de la forêt).
En captivité, il utilise des rameaux et l'antenne de son collier-émetteur pour extraire des insectes sous l'écorce et pour se toiletter mutuellement ou personnellement.
Il vit généralement en groupe de 5 à 6 individus (de 2 à 16).
La structure sociale est variable. Groupe unimâle ou groupe multimâle-multifemelle. À Poço das Antas, la grande majorité des groupes inclut soit plusieurs mâles adultes, soit plusieurs femelles adultes. Polygynie ou polyandrie. Monogamie rare. Polygynie stable avérée. Polyandrie peut-être conjoncturelle (correspondant à une période de transition au sein du groupe). Globalement, 40 % des groupes comprennent deux mâles adultes non apparentés à la femelle reproductrice et 70 % des mâles adultes participent à la reproduction mais le dominant a tendance à monopoliser sa partenaire. De même, quelques femelles subordonnées se reproduisent (dans 10,6 % des 211 groupes étudiés), seulement en l’absence d’agression de la part des femelles dominantes, et la chance de survie de leur progéniture est deux fois plus faible que celle dominantes.
Équilibre des sexes. Il semblerait toutefois que le sexe qui fonde le groupe établirait une dominance s’exprimant par la préséance alimentaire.
Les individus des deux sexes émigrent: les jeunes femelles partent les premières, à l’inverse de ce que l’on observe chez la plupart des autres primates, en raison de la compétition intrasexuelle, tandis que les mâles se dispersent pour éviter la consanguinité. Seules un quart des femelles immigrantes parviendront à intégrer un nouveau clan.
La parade sexuelle inclut des reniflements, de l’épouillage mutuel et des mouvements rapides de la langue. La copulation se déroule en position dorsoventrale. La période de reproduction commence en mai. La femelle met bas pour la première fois autour de 29 mois et connaît un œstrus post-partum 3 à 10 jours après la mise bas. Une ou deux fois par an, des jumeaux viennent au monde après une gestation variant entre 125 et 132 jours. La saison des naissances s’étale entre septembre et mars, qui est la période la plus chaude et la plus humide de l’année, avec un pic à la fin octobre.
La mère transporte seule ses jumeaux durant les deux premières semaines, plus longtemps encore en cas de naissance unique, leur donnant plusieurs fois par jour un lait très riche en protéines. Puis, elle les transfère au père. Chez les autres callitrichidés, la prise en charge est bien plus précoce, parfois dès le premier ou deuxième jour. Tous les membres du groupe participent à l’élevage des jeunes (transport, toilettage, partage de la nourriture). Les individus mâles ont tendance à transporter plus souvent les jeunes mâles que les jeunes femelles. Dès 3 semaines, commence à ingérer des aliments solides, à 5 semaines explore seul son environnement, à 3 mois peut voyager seul et exhibe ses premiers comportements sexuels (marquage circumgénital et sternal, monte simulée). Maturité sexuelle vers 2 ans.
14-15 ans (en captivité)
17 vocalisations différentes, notamment trilles, gémissements ultrasoniques, gloussements et cris de vigilance. Répertoire similaire à celui du petit singe-lion à tête dorée (Leontopithecus chrysomelas). Il existe un certain dimorphisme sexuel dans ces appels. Pour avertir de la présence d’un prédateur, il pousse une série de gloussements anxieux. Si le danger vient du ciel (rapace), il change de registre et émet des pépiements caractéristiques. L’appel typique est un appel long de 3 phrases (cri de départ, gémissements et gloussements), produit à fin territoriale ou pour raffermir les liens du couple. L’une de ces trois phrases peut être émise individuellement et véhiculer un sens différent (cri de départ pour marquer sa position, gloussements contre les prédateurs terrestres). Les deux premières phrases sont parfois seules émises (cri de cohésion). Cri suraigu de détresse (enfant).
Au nombre des démonstrations visuelles agressives de cette espèce, citons les regards fixes, les dents révélées, le dos arqué, le hérissement des poils (piloérection) et les battements de queue.
Le marquage olfactif s’avère plus fréquent que chez les autres callitrichidés et il utilise davantage les glandes sternales que circumgénitales.
Pelotonnage.
Aigles. Ocelot. Boa constrictor.
Déforestation, pâturage, agriculture ,charbonnage et braconnage. 40 % de l’habitat où il survit n’est pas protégé.
RB de Poço das Antas (comté de Silva Jardim), RB d’União (entre Casimiro de Abreu et Rio das Ostras) et PM de Taquara, dans l’État de Rio de Janeiro (Brésil). Conservé dans 27 fazendas, les principales étant : Rio Vermelho (62 individus) - ville de Rio Bonito juste à l’ouest de Silva Jardim -, Dos Irmãos (38), São Francisco (28), Coqueiro (28), Santa Helena (26), Iguape (26), Igarape (18), Maratua (16), Estreito (11) + Sanctuaire de Bom Retiro (8) - ville d’Aldeia Velha juste à l’ouest de Casimiro de Abreu.
Leontopithecus rosalia • Petit singe-lion, Singe-lion doré
Le Tamarin-lion doré,, Singe-lion doré ou Petit singe-lion (Leontopithecus rosalia) est une espèce de primate de la famille des Callitrichidae.
Tamarin singa emas (Leontopithecus rosalia) juga diketahui sebagai Marmoset emas, adalah monyet kecil dari famili Cebidae. Spesies ini merupakan spesies asli hutan pantawi Atlantik Brasil. Tamarin singa emas adalah spesies terancam dan salah satu binatang terlangka di dunia, dengan perkiraan populasi 1.000 di alam bebas dan 500 di penangkaran.
Tamarin singa emas (Leontopithecus rosalia) juga diketahui sebagai Marmoset emas, adalah monyet kecil dari famili Cebidae. Spesies ini merupakan spesies asli hutan pantawi Atlantik Brasil. Tamarin singa emas adalah spesies terancam dan salah satu binatang terlangka di dunia, dengan perkiraan populasi 1.000 di alam bebas dan 500 di penangkaran.
La grande scimmia leonina o leontocebo rosalia (Leontopithecus rosalia Linneo, 1766) è un primate platirrino della famiglia dei Cebidi.
Vive nella zona costiera sud-orientale del Brasile, dove colonizza le aree di foresta atlantica.
Misura complessivamente circa 70 cm, con la coda che è solitamente più lunga del corpo di 10–15 cm. Il peso medio è di circa 650 g.
Il pelo è lungo e soffice, di consistenza setosa e di un colore che va dall'arancio dorato al giallo albicocca: attorno alla testa e sul collo il pelo è particolarmente lungo, formando una sorta di criniera (da qui l'aggettivo "leonina"), che può essere gonfiata drizzando i peli. In particolare, questi animali possiedono due ciuffi di pelo al di sopra delle sopracciglia, che ricadono lateralmente andandosi a fondere col resto della criniera, ma che tuttavia sono particolarmente erettili.
La faccia è appiattita, glabra, con due narici assai distanziate: la pelle è di colore grigiastro. Le mani non presentano pollici opponibili: hanno inoltre unghie appuntite (dette tegulae), fatta eccezione per i pollici, i quali presentano unghie larghe ed appiattite.
Si tratta di animali diurni ed arboricoli: durante la notte, cercano riparo in cavità dei tronchi d'albero, mentre di giorno, per sfuggire alle ore più torride della giornata, si riposano al riparo nella vegetazione più fitta. Vivono in gruppi che contano da due a otto individui, composti da una coppia dominante e dai cuccioli di due o tre parti precedenti: a volte, possono entrare a far parte del gruppo anche parenti della femmina dominante.
Per il resto, si tratta di animali piuttosto territoriali, che delimitano la propria zona tramite messaggi odorosi (che vengono lasciati strofinando delle particolari ghiandole soprapubiche contro supporti in zone di confine con altri territori) e particolari vocalizzazioni. Qualora qualche intruso violi i confini del territorio e lo invada, viene solitamente accolto dal gruppo proprietario di quest'ultimo che lo fissa in maniera insistente: qualora l'intruso insista nell'invasione, sopraggiungono manifestazioni di minaccia come la bocca aperta con le labbra tese (in modo tale da scoprire i denti) o la "posizione della strega", dove la schiena viene inarcata ed il corpo tenuto lateralmente rispetto all'intruso, coi peli ben eretti per aumentare il volume corporeo. Raramente si arriva a manifestazioni violente.
Nell'ambito del gruppo, si tratta di animali molto attaccati gli uni agli altri: sono fra i pochi callitricidi dediti al grooming (in particolare sono principalmente i maschi a praticarlo sulle femmine), mentre sia i giovani che gli adulti passano molto tempo giocando fra di loro (lotta, rimpiattino) ed emettendo vocalizzazioni quasi continue, che sono l'unico tipo di dimorfismo sessuale presente in questa specie, poiché sono leggermente differenti nei due sessi.
Le scimmie leonine sono animali onnivori: si nutrono principalmente di frutta ed invertebrati, ma qualora si presenti l'occasione non disdegnano di integrare la propria dieta con piccoli vertebrati (lucertole, nidiacei) e uova. Per catturare gli insetti e le loro larve, utilizzano le lunghe ed affusolate dita armate di artigli per scavare nel legno marcescente e mettere allo scoperto i loro nidi: questa tecnica prende il nome di "micromanipolazione". Spesso i componenti di una coppia dividono il cibo fra loro o coi loro cuccioli, mentre è più raro che offrano del cibo da loro trovato ad altri membri del gruppo.
Il periodo riproduttivo cade in natura durante la stagione delle piogge, ossia fra settembre e marzo nell'emisfero australe: la femmina può portare a termine con successo anche due gravidanze l'anno. Come nelle altre specie di callitricidi, la femmina dominante è anche l'unica a potersi riprodurre, impedendo alle altre femmine del gruppo (solitamente sue figlie o parenti) di raggiungere l'ovulazione mediante l'emissione di feromoni.
La gestazione dura generalmente poco più di quattro mesi, al termine dei quali vengono dati alla luce solitamente due gemelli (ma può accadere che nasca un unico cucciolo, così come tre o quattro gemelli) che pesano circa 55 g ed alla nascita sono già ricoperti di pelo ed hanno gli occhi aperti. Sono tuttavia del tutto dipendenti dalle cure dei genitori: per le prime due settimane è la madre a portarli, tenendoli attaccati al ventre ed al dorso. In seguito è il padre che si accolla i cuccioli, spesso coadiuvato anche dagli altri membri del gruppo, lasciandoli alla madre solo per la poppata, ossia all'incirca ogni due o tre ore. Curiosamente, in questa specie è stato osservato che i giovani alle prime armi con l'allevamento di cuccioli tendono a prendersi cura preferibilmente di cuccioli del loro stesso sesso, mentre gli adulti con esperienza non fanno differenza fra maschi e femmine.
I cuccioli vengono svezzati completamente attorno al mese e mezzo d'età, anche se cominciano a prendere confidenza coi cibi solidi già a partire dalla terza settimana di vita. Essi restano nell'ambito del gruppo anche dopo aver raggiunto la maturità sessuale, ossia a circa un anno e mezzo per le femmine ed a due anni per i maschi. Questi ultimi sono anche i primi ad allontanarsi dal gruppo, attorno ai tre anni d'età. La speranza di vita di questi animali in natura si aggira attorno ai 15 anni, mentre in cattività supera facilmente i 20 anni: il record di longevità appartiene ad un esemplare in cattività vissuto 28 anni.
La cattura indiscriminata di questi magnifici primati da parte della popolazione locale per venderle come animali da compagnia o come cavie da laboratorio, unitamente alla distruzione sistematica dell'habitat per far spazio ad insediamenti umani od a coltivazioni ha fatto sì che il numero di scimmie leonine in natura precipitasse, tanto che nel 1982 la specie fu classificata dall'IUCN come in pericolo, stato che nel 1993 passò a critico.
Prima che l'estinzione divenisse inevitabile, molti zoo in possesso di questi animali unirono i propri sforzi per tentarne la riproduzione in cattività, al fine di intraprenderne in un futuro prossimo la reintroduzione nel vecchio areale.
Fortunatamente, pare che le scimmie leonine si riproducano bene in cattività e non soffrano eccessivamente la prigionia, e quindi il loro numero è cresciuto negli anni sia in cattività che allo stato selvatico, dove nuove popolazioni sono state introdotte in alcuni parchi nazionali con ottimi risultati[1]: attualmente si contano circa 500 esemplari in cattività e più di un migliaio in natura, concentrati nella riserva biologica di Poço de Antas, nei pressi di Rio de Janeiro, e lo status della specie è nuovamente sceso a in pericolo.
Nel manga e anime Mew Mew - Amiche vincenti la co-protagonista Pudding Wong[2] mescola il suo DNA con quello della scimmia leonina, potendosi così trasformare in una specie di scimmia leonina umana.
La grande scimmia leonina o leontocebo rosalia (Leontopithecus rosalia Linneo, 1766) è un primate platirrino della famiglia dei Cebidi.
Auksaspalvė liūtbeždžionė (lot. Leontopithecus rosalia, angl. Golden Lion Tamarin, vok. Goldgelbes Löwenäffchen) – kabiauodegių beždžionių (Cebidae) primatų rūšis. Veidas tamsiai pilkas, o plaštakos ir rankų pirštai ilgi ir ploni, kad galėtų iš žievės ir plyšių iškrapštyti vabzdžių lervas. Tačiau apie keturis penktadalius maisto sudaro vaisiai, kuriuos papildo sakai ir nektaras. Maitinasi dieną, o naktį miega sąžalynuose arba dažniau medžio drevėje.
Auksaspalvė liūtbeždžionė (lot. Leontopithecus rosalia, angl. Golden Lion Tamarin, vok. Goldgelbes Löwenäffchen) – kabiauodegių beždžionių (Cebidae) primatų rūšis. Veidas tamsiai pilkas, o plaštakos ir rankų pirštai ilgi ir ploni, kad galėtų iš žievės ir plyšių iškrapštyti vabzdžių lervas. Tačiau apie keturis penktadalius maisto sudaro vaisiai, kuriuos papildo sakai ir nektaras. Maitinasi dieną, o naktį miega sąžalynuose arba dažniau medžio drevėje.
Zeltainais lauvpērtiķis (Leontopithecus rosalia) jeb zeltainais lauvtamarīns ir primātu suga[1], kas dzīvo Klusā okeāna piekrastē Brazīlijā. Neskarti palikuši vairs tikai 2 — 3 procenti no sugas pirmatnējās vides un, ar garajām astēm un zīdainājām krēpēm apveltīti, tie ir vieni no skaistākajiem, taču arī apdraudētākajiem pērtiķiem pasaulē.
Lauvpērtiķu ģintij pieder vēl trīs sugas, kuru ārieni raksturo to nosaukumi — zeltgalvas lauvpērtiķis (L. chrysomelas), melnais lauvpērtiķis un melnsejas lauvpērtiķis (L. caissara). Tās visas apdzīvo nedaudzos lietus mežu pleķīšos, kas saglabājušies Brazīlijas dienvidaustrumos.
Ķermeņa garums 26 – 33 cm, astes garums 32 – 40 cm.[2] Apmatojums garš un zīdains, vienmērīgi sarkanzeltains un spīdīgs. Galvenā pazīme ir "lauvas" krēpes, kas aptver visu ģīmīti. Seja kaila, ar rozīgi violetu nokrāsu.
Pēdas garas un tievas, ar ļoti gariem pirkstiem. Kā visiem kalitriksu dzimtas pārstāvjiem, uz priekšējām un pakaļējām kājām ir asi, līki nadziņi. Tā ir dzimtas visraksturīgākā pazīme.[1][3]
Šādi grāmatā "Šķirsta jubileja" zeltainos lauvtamarīnus apraksta Džeralds Darels:
"Zeltainais lauvtamarīns varbūt ir visskaistākais zīdītājs pasaulē. Dzīvnieks ir mazliet lielāks par tikko piedzimušu kaķēnu, tam ir ārkārtīgi gari "mākslinieka" pirksti un kuplas krēpes, kas izskatās gluži kā no zelta. Šis apbrīnojamais, vizošais kažoks iekļauj tamarīna seju kā pa pusei saslējušās krēpes, tā dēļ dzīvnieks izskatās pēc lauvas... Tamarīnu kažoki saules staros vizēja krāsu miriādēs — no smilšakmens sarkanā līdz blāvi zeltainam".
Sastopams trīs nelielos areālos šaurā piekrastes džungļu joslā Brazīlijas dienvidaustrumos.[3]
Zeltainā lauvpērtiķa dabiskā vide ir tropu lietus meži. Dzīvo koku lapotnē 10 – 20 m augstumā. Tā kā ir ļoti jūtīgs pret tiešu saules iedarbību, pusdienas tveicē slēpjas biezajā lapotnē. Viņu balsis atgādina putnu čivināšanu, spalgos ķērcienus un treļļus. Naktis pavada koku dobumos, kur rod patvērumu no plēsējiem un vēsuma.[3]
Kā visi kalitriksi un tamarīni, ārkārtīgi veikli un strauji pārvietojas starp koku zariem, reizēm tādā ātrumā, ka nav iespējams izsekot kustībai ar acīm. Cieši pieķeras pie mizas ar garajiem pirkstiem, kuriem ir stipri nagi. Atšķirībā no citām pērtiķu sugām zeltainais lauvpērtiķis neizmanto savu garo asti, lai pieturētos pie zara.
Dzīvo pastāvīgās ģimenēs. Sazinās, izmantojot mīmiku. Viens no svarīgākajiem pienākumiem ir ikdienas kažoka aprūpe. Šī darbība stiprina ģimenes saites. Pērtiķi cits citam tīra pat zobus. Būdami cits pret citu ļoti draudzīgi un koleģiāli, svešiniekiem bara locekļi uzbrūk ļoti agresīvi. Nobiedēts lauvpērtiķis sabož krēpes, atņirdz zobus un raida spalgus spiedzienus. Ja tuvumā pamana tā paša dzimuma dzīvnieku, kas nav no viņa dzimtās grupas, var sākties kautiņš, kas reizēm pat beidzas ar viena pretinieka nāvi.
Zeltainai lauvpērtiķis ir visēdājs un lieto uzturā gan augu gan dzīvnieku izcelsmes barību. Ēdienkartē ietilpst dažādi augļi, lapas, ziedi un to nektārs, reizēm arī kukaiņus, zirnekļus, vardes, ķirzakas, gliemjus un putnu olas. Dienas laikā var ierāpties koku dobumos un pievienot savai ēdienkartei tur miegā karājošos sikspārņus.
Var vairoties visa gada garumā un dzīvo pastāvīgās attiecības. Atšķirībā no citām pērtiķu sugām kallitriksu tēviņi palīdz mātītēm dzemdībās. Mazuļu skaits no 1 — 3, parasti 2. Tēviņš ir galvenais mazuļu aprūpētājs — viņš paņem jaundzimušos, aplaiza un nožāvē.
Mazuļi ir līdzīgi saviem vecākiem, viņiem ir īss apmatojums un trūkst vienīgi krēpju. Mazie lauvpērtiķi cieši turas ar kājām un rokām pie vecāku spalvām. Visbiežāk mazuļus nēsā tēviņš, kas pērtiķu vidū arī ir neparasta parādība. Ik pēc divām trim stundām tēviņš iedod vienu mazuli mātei, kas viņu baro apmēram 15 minūtes, pēc tam atdod to atpakaļ tēvam. Novērots, ka tēviņi lobījuši banānu, saspaidījuši to plaukstā un barojuši mazuļus. Apmēram pēc trim nedēļām mazuļi sāk iepazīt apkārtni, bet vismazāko briesmu brīžos atgriežas pie vecākiem. Līdz pat sešu septiņu mēnešu vecumam vecāki nēsā viņus uz muguras.
Četras nedēļas veci zeltainie lauvpērtiķi jau uzņem pastāvīgu, pagaidām vēl mīkstu barību, kaut arī māte turpina viņus zīdīt. Mazuļi kļūst patstāvīgi, kad tiem ir trīs līdz pieci mēneši, taču vēl atgriežas pie vecākiem, kolīdz jūtas apdraudēti vai vēlas izdiedelēt barību. Mātītes dzimumgatavību sasniedz pēc 18, tēviņi — 24 mēnešiem.[3]
Ilgu laiku lauvpērtiķus ķēra zooloģiskajiem dārziem. Kopš 18. gadsimta tas kļuva iemīļots mājdzīvnieks. Līdz pat 1960. gadam likums ļāva ķert un izvest šos dzīvniekus no valsts.
Lauvpērtiķis var izdzīvot vienīgi dabiskā mežā. Arvien biežāka mežu izciršana un pirmatnēji džungļu izpostīšana atņēmusi šai sugai dabisko vidi, no kuras tā ir atkarīga. Džungļu izciršana nebija vienīgais iemesls, kāpēc samazinājās šo dzīvnieku skaits. Skaistā kažoka dēļ lauvpērtiķus ķēra kažokādu ieguvei, kā arī zooloģiskajiem dārziem.
20. gadsimta 70. gados Savienotās Valstis sāka šī pērtiķa aizsardzības programmu, nometinot dzīvniekus izvēlētās teritorijās, visvairāk Pokodeantā (Pocos des Antas). Tā ir 5100 hektārus liela teritorija Riodežaneiro tuvumā. 1983. gadā šajā rezervātā sāka izmitināt dzīvniekus, kas izaudzēti nebrīvē. Savvaļā tika izlaists 71 pērtiķis. 1978. gadā projektā iesaistījās Darela zooloģiskais dārzs. 1991. gadā bija atlikuši ap 200 zeltaino lauvpērtķu, un aizsardzības pasākumu rezultātā to skaits šobrīd pārsniedz 1000 īpatņu. Visi lauvpērtiķi 1990. gadā simboliski tika nodoti Brazīlijas valdībai un izsludināta visas ģints aizsardzības programma.
Zeltainais lauvpērtiķis (Leontopithecus rosalia) jeb zeltainais lauvtamarīns ir primātu suga, kas dzīvo Klusā okeāna piekrastē Brazīlijā. Neskarti palikuši vairs tikai 2 — 3 procenti no sugas pirmatnējās vides un, ar garajām astēm un zīdainājām krēpēm apveltīti, tie ir vieni no skaistākajiem, taču arī apdraudētākajiem pērtiķiem pasaulē.
Lauvpērtiķu ģintij pieder vēl trīs sugas, kuru ārieni raksturo to nosaukumi — zeltgalvas lauvpērtiķis (L. chrysomelas), melnais lauvpērtiķis un melnsejas lauvpērtiķis (L. caissara). Tās visas apdzīvo nedaudzos lietus mežu pleķīšos, kas saglabājušies Brazīlijas dienvidaustrumos.
Het gouden leeuwaapje of gewoon leeuwaapje (Leontopithecus rosalia) is een bedreigd klauwaapje. Het is de bekendste van de vier soorten leeuwaapjes (Leontopithecus). Hij komt enkel voor in het ernstig versnipperde Atlantische regenwoud in het zuidoosten van Brazilië. Het gouden leeuwaapje is sinds de jaren zestig onderwerp van een intensieve beschermingscampagne, geleid door het Smithsonian Institution. Dit heeft geleid tot een wereldwijd fokprogramma in dierentuinen en een succesvol herintroductieproject. Eens bijna uitgestorven leven er nu weer meer dan duizend gouden leeuwaapjes in het wild.
Het gouden leeuwaapje wordt beschouwd als een van de mooiste apensoorten. Hij heeft een zijdeachtige, rossige (soms wittige), goudoranje vacht en manen, die de oren bedekken. Het gezicht is naakt en donker van kleur. Hij wordt 20 tot 25 centimeter lang,[2] de staart is tussen de 31,5 en de 40 centimeter lang. Het lichaamsgewicht bedraagt 600 tot 800 gram. Het is een van de grotere soorten klauwaapjes.
Het gouden leeuwaapje komt enkel voor in het Atlantische kustregenwoud in de staat Rio de Janeiro, Brazilië. Tegenwoordig is de verspreiding beperkt tot enkele bossen in het stroomgebied van de Rio São João. Het zijn echte boombewoners.
Gouden leeuwaapjes foerageren voornamelijk overdag, maar ook 's nachts. Ze eten voornamelijk sappige vruchten en scheuten. Ook jagen ze op insecten, spinnen en hagedisjes. Ook eten ze honing, gom en vogeleieren. Met zijn lange, dunne vingers en handen kan hij keverlarven en andere insecten vinden onder de bast of in boomspleten. 's Nachts schuilen ze in een boomholte, een enkele keer tussen dichte beplanting van takken en lianen.
Gouden leeuwaapjes leven in familiegroepjes van vier tot elf dieren, bestaande uit een paartje en hun jongen. Het groepje heeft een territorium van ongeveer 42 hectare. Enkel het dominante paartje plant zich voort. De jongen worden na een draagtijd van 132 tot 140 dagen geboren. Het wijfje krijgt meestal twee jongen per worp, waarbij het ene jong zich aan de buik vastklampt, en het andere aan de rug. Beide ouders zorgen voor de jongen, evenals de overige groepsleden.
Gouden leeuwaapjes kunnen ongeveer 14 jaar oud worden. Een gouden leeuwaapje in de dierentuin van San Diego leefde nog in december 1995 op de leeftijd van 28 jaar en twee maanden. Natuurlijke vijanden van het gouden leeuwaapje zijn onder andere de ocelot, slangen en roofvogels als arenden en haviken.
In de negentiende eeuw kwam het gouden leeuwaapje nog in de hele staat Rio de Janeiro voor. Door versnippering van het leefgebied (Zuidoost-Brazilië is een van de dichtstbevolkte gebieden in Zuid-Amerika en door de stranden zeer populair onder toeristen) was het gouden leeuwaapje echter bijna uitgestorven geweest. Ook de handel vormde een grote bedreiging; door zijn aantrekkelijke uiterlijk was het gouden leeuwaapje populair onder dierentuinen en liefhebbers van exotische huisdieren, en werden vele leeuwaapjes uit hun natuurlijke leefgebied weggehaald. Sinds het begin van de jaren zeventig is de handel in leeuwaapjes wereldwijd verboden. Tegenwoordig wordt het gouden leeuwaapje beschouwd als een van de ernstigst bedreigde primatensoorten.
Vanaf de jaren zestig van de twintigste eeuw is actie ondernomen om de soort te redden van de ondergang. Een fokprogramma werd opgestart in dierentuinen en gebieden waar de soort nog voorkwam, werden opgekocht. Ook werden er populaties uit bedreigde gebieden verplaatst naar veilige bossen. Helaas werden twee van de belangrijkste bossen in 1971 gekapt voordat er genoeg geld was ingezameld om de gebieden te kopen. Tegenwoordig leeft het grootste deel van de wilde populatie in het Reserva Biológica de Poço das Antas en het Reserva Biológica União. Dankzij het fokprogramma is er nu een stabiele populatie van zo'n vijfhonderd leeuwaapjes in dierentuinen. Enkele van deze dierentuinaapjes zijn sinds 1984 weer uitgezet. Zo'n veertig procent van de totale populatie in het wild stamt af van deze aapjes.
Sinds 2003 leven er weer zo'n duizend gouden leeuwaapjes in het wild. De populatie kan echter niet meer uitbreiden door de versnippering van het leefgebied. Om dit probleem te verhelpen, zal er in de toekomst open gebied tussen de wilde populaties worden herbebost.
Bronnen, noten en/of referentiesHet gouden leeuwaapje of gewoon leeuwaapje (Leontopithecus rosalia) is een bedreigd klauwaapje. Het is de bekendste van de vier soorten leeuwaapjes (Leontopithecus). Hij komt enkel voor in het ernstig versnipperde Atlantische regenwoud in het zuidoosten van Brazilië. Het gouden leeuwaapje is sinds de jaren zestig onderwerp van een intensieve beschermingscampagne, geleid door het Smithsonian Institution. Dit heeft geleid tot een wereldwijd fokprogramma in dierentuinen en een succesvol herintroductieproject. Eens bijna uitgestorven leven er nu weer meer dan duizend gouden leeuwaapjes in het wild.
Løveape eller løvetamarin (Leontopithecus rosalia) er ein liten primat i silkeapefamilien, Callitrichidae. Arten er mellom anna i slekt med silkeapa.
Arten er den største i silkeapefamilien med ei kroppslengd på 34-40 cm og halelengd på 26-38 cm. Vekta er på 630-710 g. Pelsen er raudgul, og dei lange håra på issen, kinna og sidene av halsen kan reisast opp som ein man. Ulikt dei fleste apar har løveapa klør i staden for neglar. Hannar og hoer ser heilt like ut.
Føda er frukt og grønsaker, men også insekt, edderkoppar og smådyr. Apa kan bli opptil 10-15 år gamal. Løveapa høyrer endemisk til dei atlantiske kystskogane i Brasil. Ho lever høgt oppe i trekrunene, om lag 30 meter over bakken, eller meir.
Apa er truga av skoghogst; ein rekner med at berre 2 %–5 % av det opphavlege leveområdet deira er att.[1] I vill tilstand finst berre nokre hundre eksemplar att. Dei finst berre i tre små regnskogsområde i Søraust-Brasil: Poço das Antas Biological Reserve, Fazenda União biologiske reservat og private landområde knytt til eit reintroduksjonsprogram.[2]
Det finst rundt 490 individ i fangenskap i 150 ulike dyrehagar.[3][2][4] I Skandinavia finst arten mellom anna i Ålborg Zoo og Kristiansand Dyrepark.
Løveape eller løvetamarin (Leontopithecus rosalia) er ein liten primat i silkeapefamilien, Callitrichidae. Arten er mellom anna i slekt med silkeapa.
Løvetamarin (Leontopithecus rosalia) er en vestape i gruppen silkeaper, som opprinnelig holder til i det sørøstre Brasil. Den er ca. 40 cm lang (pluss tilsvarende hale), veier 600–700 gram og kan nå en alder på 10-15 år. Løvetamarin (eller løveape) er den største av de såkalte silkeapene.
Løvetamarin er en dagaktiv ape som lever i trær, og spiser insekter, edderkopper, padder, egg, små virveldyr, skudd, frukter og blader. Ulike de fleste aper har den klør i stedet for negler. Hanner og hunner ser helt like ut, den er altså ikke dimorf. Hunnene går drektige i 5 måneder.
Arten lever i familiegrupper, og holder til høyt oppe trekronene – om lag 30 meter oppe eller mer. Den er truet av skogshogst, og finnes bl.a i Ålborg Zoo og Kristiansand Dyrepark. I vill tilstand er det bare 200–300 individer igjen.
Løvetamarin har gyllen manke og hode, men lys gyllen til hvit kropp. Arten likner den nære slektningen (varianten) Gyldenhode-løvetamarin (Leontopithecus rosalia chrysomelas), men sistnevnte har svart kropp og gyllen manke.
Løvetamarin (Leontopithecus rosalia) er en vestape i gruppen silkeaper, som opprinnelig holder til i det sørøstre Brasil. Den er ca. 40 cm lang (pluss tilsvarende hale), veier 600–700 gram og kan nå en alder på 10-15 år. Løvetamarin (eller løveape) er den største av de såkalte silkeapene.
Løvetamarin er en dagaktiv ape som lever i trær, og spiser insekter, edderkopper, padder, egg, små virveldyr, skudd, frukter og blader. Ulike de fleste aper har den klør i stedet for negler. Hanner og hunner ser helt like ut, den er altså ikke dimorf. Hunnene går drektige i 5 måneder.
Arten lever i familiegrupper, og holder til høyt oppe trekronene – om lag 30 meter oppe eller mer. Den er truet av skogshogst, og finnes bl.a i Ålborg Zoo og Kristiansand Dyrepark. I vill tilstand er det bare 200–300 individer igjen.
Løvetamarin har gyllen manke og hode, men lys gyllen til hvit kropp. Arten likner den nære slektningen (varianten) Gyldenhode-løvetamarin (Leontopithecus rosalia chrysomelas), men sistnevnte har svart kropp og gyllen manke.
Marmozeta lwia[5] (Leontopithecus rosalia) – gatunek południowoamerykańskiej małpy szerokonosej. Zamieszkuje lasy deszczowe południowo-wschodniej Brazylii. Zasięg występowania gatunku jest ograniczany z powodu fragmentacji i zmniejszania areału lasów. Żyje w grupach rodzinnych zbudowanych wokół samca i samicy. Tworzy zwykle małe populacje, zagrożone chowem wsobnym. Spożywa pokarm roślinny i zwierzęcy. Podlega ochronie i poddawany jest reintrodukcji.
Marmozetę lwią zalicza się do małp szerokonosych. Podział tej grupy na rodziny ulegał zmianom w miarę rozwoju wiedzy o pokrewieństwie w jej obrębie. Początkowo wyróżniono tylko dwie rodziny: płaksowate (Cebidae) i pazurkowcowate (Callitrichidae). Ta propozycja Pococka z 1925 akceptowana była przez licznych badaczy[2], niekiedy tylko wyodrębniano gatunek miko czarny do odrębnej rodziny[6]. W 1976 Thorington zaproponował podział płaksowatych na dwie podrodziny – Callitrichinae i Callimiconinae. Nie zgodził się z tym Rosenberger. Uznał on podrodzinę Callitrichinae, definiując ją poprzez wskazanie pewnych cech dłoni i zębów, ale oprócz marmozet i tamaryn zaliczył tu też rodzaj Calimico, wyłączany przedtem do odrębnej podrodziny. Sam wyróżnił natomiast podrodzinę Cebinae, w której umieścił rodzaje Cebus i Saimiri. Resztę szerokonosych zaklasyfikował do rodziny czepiakowatych (Atelidae). Dokonał też dalszego podziału podrodziny Callitrichinae. Wyróżnił w jej obrębie 2 plemiona – Callitrichini i Callimiconini (takson monotypowy tylko z rodzajem Callimico). Callitrichini podzielił z kolei na 2 podplemiona – Callitrichina (rodzaje Callithirix, Cebuella i Leontopithecus) i Leontocebina. Tak więc do najbliższych krewnych marmozet należą przedstawiciele rodzajów Callithirix i Cebuella[3].
Książka Wolfheima z 1983 traktuje pazurkowcowate jak rodzinę (Callitrichidae)[7].
W 1995 uznawano monofiletyczną rodzinę Callitrichidae, o rodzajach Callithirix, Cebuella, Leontopithecus, Saguinus i Callimico, chociaż różne metody analizy pokrewieństwa w tej grupie dawały różne kladogramy[8]. W 2000 nadal umieszczano marmozetę lwią w tej rodzinie[9].
Nowsze badania DNA mitochondrialnego przeprowadzone przez Chatterjee i współpracowników opublikowane w 2009 umieszczają marmozetę lwią w rodzinie płaksowatych, stwierdzając jednocześnie, że rodzina taka nie byłaby monofiletyczna[6]. Muhlberger przyjmuje w swej dysertacji podział małp szerokonosych tylko na dwie rodziny: Atelidae i Cebidae. W tej ostatniej wymienia 3 podrodziny: Callitrichinae, Cebinae i Aotinae. W tej pierwszej umieszcza rodzaje Callithrix, Callimico, Leontopithecus i Saguinus[10]. Dwa ostatnie z wymienionych rodzajów naukowiec uznaje za siostrzane[11].
Mammal Species of the World pod redakcją Wilsona i Reedera również umieszcza rodzaj Leontopithecus w rodzinie Cebidae, a w jej obrębie w podrodzinie Callitrichinae[4].
W obrębie rodzaju Leontopithecus znajdują się także przynajmniej 2 inne gatunki, jak Leontopithecus caissara i Leontopithecus chrysopygus[3]. Zazwyczaj zalicza się tam też Leontopithecus chrysomelas[4]. Niegdyś 2 ostatnie z wymienionych traktowano jako podgatunki w obrębie L. rosalia. Pogląd taki wyraża Wolfheim w swej książce z 1983[7], a także Eisenberg i Redford w pozycji z 2000[9].
Kladogram uzyskany dzięki analizie mtDNA z pracy Chatterjee i współpracowników, 2009[6], znacznie uproszczono, gatunki i rodzaje zaliczone przez autorów do polifiletycznej rodziny Cebidae zaznaczono linią pogrubioną:
Leontopithecus rosalia
Kladogram obejmujący tylko rodzaje na podstawie analizy DNA jądrowego, ta sama praca[6], znacznie uproszczono:
W 2001 przeprowadzono badania mikrosatelitarnego DNA marmozety lwiej. W 4 na 5 badanych loci doszukano się polimorfizmu. Maksymalna liczba alleli na 1 locus wyniosła 4. Dla poszczególnych loci liczba ich alleli przedstawiała znaczne różnice pomiędzy poszczególnymi populacjami. Heterozygotyczność wynosiła od 0,34 ± 0,13 do 0,65 ± 0,09 i najwyższa była w Poço das Antas, gdzie żyje największa populacja. Utrata alleli była też szybsza od straty heterozygotyczności. Wyniki obliczeń nie zgadzały się z przewidywaniami czynionymi na podstawie prawa Hardy’ego-Weinberga: zaobserwowano deficyt heterozygotyczności. Doszukano się też nierównowagi sprzężeń. Utrata heterozytotyczności wiąże się ze zmniejszeniem różnorodności genetycznej gatunku, zapewne w przypadku izozymów mniejszej jeszcze, niż w przypadku mikrosatelitarnego DNA. Podobne tendencje zaobserwowano u ssaków zamieszkujących lasy innych rejonów świata, np. Tajlandię, a nawet u hawajskich komarów. Z drugiej strony pazurkowcowate generalnie charakteryzują się niską różnorodnością genetyczną, nawet w przypadku alleli klasy I głównego układu zgodności tkankowej; częste są u nich bliźnięta dizygotyczne, w szpiku kostnym których wykrywa się mikrochimeryzm. Sądzi się, że obserwowana mała różnorodność u tego gatunku istniała pierwotnie, przed fragmentacją lasów i nie jest jej skutkiem. Różnice genetyczne cały czas korelują z różnicami geograficznymi[12].
Wśród cech wyróżniających marmozety i tamaryny wśród pazurkowcowatych IUCN wymienia niewielkie rozmiary ciała oprócz budowy paznokci, liczby trzonowców i częstości urodzeń bliźniąt[2].
Natomiast Eisenberg i Redford uznają tę małpę za największego przedstawiciela Callitrichidae. Podają wymiary 20,0-33,6 cm w przypadku ciała wraz z głową oraz 40 cm długości ogona[9]. Dorosłe osobniki trzymane w niewoli osiągają masę ciała od 550 do 850 g[13] lub od 600 do 800, średnio 710 g[9]. Zaznacza się w niej dymorfizm płciowy: samce są cięższe od samic (średnia masa ciała wynosi odpowiednio 620 i 598 g)[13].
Ubarwione są na czerwonozłoto, choć mogą też pojawiać się zwierzęta prawie białe. Kolor brązowy obserwuje się na końcu ogona i na rękach[9].
Noworodki cechują się drożnym narządem Jacobsona, który łączy się z przewodem nosowo-podniebiennym. U zbadanych noworodków mierzył on od 1,15 do 1,8 μm. Cechuje się on najbardziej pierwotną budową spośród narządów przylemieszowych noworodków pazurkowców. Narząd ten rośnie z wiekiem. Otwiera się ku przodowi, ku tyłowi łącząc się z przewodami wyprowadzającymi gruczołów[14].
Marmozeta posiada tylko dwa zęby trzonowe[2].
Inaczej niż u innych szerokonosych, palce tamaryn i marmozet kończą się raczej pazurami niż paznokciami. Nie dotyczy to palucha. Długie dłonie i ich palce również wyróżniają marmozetę lwią wśród pazurkowcowatych[2].
Marmozeta lwia prowadzi dzienny tryb życia[13]. Małpa ta rozpoczyna swą aktywność o świcie od poszukiwania pożywienia i ćwiczeń. Wpierw zażywa światła słonecznego w najwyższych partiach lasu deszczowego, by później zejść niżej i odpoczywać podczas najcieplejszej części dnia. Pazurczatkowate te ponownie wracają do żerowania późnym popołudniem, bawią się też lub odpoczywają aż do zajścia słońca, po czym udają się razem na spoczynek nocny[15]. Nocują w dziuplach drzew[2].
Wiedza na temat zwyczajów społecznych i rozrodczych gatunku jest ograniczona[15].
Marmozety lwie porozumiewają się ze sobą między innymi za pomocą zapachów, także w przypadku rozrodu[15]. Zapachem między innymi znakują miejsca zasobne w owoce. Samce podkreślają nim swą dominację[16]. Nie stwierdzono jednak używania zapachu w zachowaniach terytorialnych[17], w przeciwieństwie do długich okrzyków[9].
Sygnały wzrokowe, słuchowe i dotykowe odgrywają mniejszą rolę[15].
Małpy te żyją w grupach rodzinnych liczących od 2[9] lub 4 do 8[2], a wedle starszych danych od 5 do 9 osobników[13]. Dietz i Kleiman oszacowali średnią liczbę osobników w grupie na 5,6 w Poço das Antas[2]. Samiec i samica tworzą dość trwałą parę, przy czym żadne z nich nie odgrywa w niej roli dominującej[15]. Pozostali członkowie grupy to ich potomstwo z jednego bądź dwu miotów[9]. Tak więc na jedną grupę przypada tylko jedna samica przystępująca do rozrodu w danym sezonie[2]. Grupa broni terytorium mierzącego 40 do ponad 100 ha, np. w Poço das Antas 21-73 ha, średnio 45±16 ha, a w União 65-229, średnio 150±72 ha. Jego powierzchnia zależy od dostępności pożywienia i udziału lasów wtórnych[2]. Obserwowano jednak kilka grup rodzinnych (15-20 zwierząt) na jednym drzewie, obfitującym w pożywienie[9].
U marmozet lwich obserwowano poligamię. Grupa poligamiczna składa się zwykle z dominującej matki i podporządkowanej jej córki. Okazuje się, że zwiększa to przeżywalność niedominujących samic, polepsza ich sytuację w grupie, daje także możliwość próby zmiany hierarchii. Matka musi także dzielić się zasobami terytorium. Taka struktura społeczna sprzyja chowowi wsobnemu. W związku z powyższym opisywaną poligamię stwierdza się średnio w 10% przypadków. Nie trwa też ona dłużej niż 2 lata. Sposobem jej uniknięcia jest agresja matczyna, a nawet przegonienie nieródek[18].
Młode samce, zmieniające grupę, nie przystępują od razu do płodzenia potomstwa. Czekają na swoją kolej, gdy pożądane przez nich miejsce przestanie zajmować starszy osobnik[9].
Jak już wspomniano, w jednej grupie rozrodczej do rozrodu przystępuje jedna samica. Ma to miejsce raz do roku[2].
Okres największej płodności zdarza się u samicy co 14-21 dni[9]. U marmozet lwich często zdarzają się bliźnięta heterozygotyczne, wykazujące zjawisko mikrochimeryzmu[15]. Występują też mioty z zarówno jednym, jak i trzema młodymi. Ciąża trwa od 125 do 132 dni[9].
Młodymi opiekuje się ojciec, mimo że samica je karmi[15]. Ojciec i starsze rodzeństwo dzielą się z młodym również upolowaną zdobyczą[9]. Mogą je nosić wszyscy członkowie grupy, a podczas podróży noszone są zazwyczaj przez osobniki inne niż ich matka, co pozwala jej zaoszczędzić energię[13].
Gatunek cechuje się ograniczonym zasięgiem występowania, obejmującym tereny położone we wschodniej Brazylii[2] wzdłuż wybrzeża Atlantyku[12], w stanie Rio de Janeiro, w basenie Rio São João. Wedle IUCN pierwotny zasięg występowania zwierzęcia obejmował następujące gminy: Mangaratiba, Itaguaí, Nova Iguaçu, Nilópolis, São João de Meriti, Duque de Caxias, Rio de Janeiro, Magé, São Gonçalo, Niterói, Itaboraí, Maricá, Araruama, Silva Jardim, Saquarema, Rio Bonito, Cachoeiras de Macacu, São Pedro da Aldeia, Cabo Frio, Casimiro de Abreu, Macaé, Conceição de Macabu, Campos oraz São João da Barra. Jednakże wyprawy badawcze Coimbra-Filho ujawniły, że w większości z podanych miejsc marmozety lwie już nie występowały. Ostały się w Silva Jardim, Cabo Frio, Saquarema, Aruarama, Casimiro de Abreu, Rio Bonito i São Pedro da Aldeia. Kolejne badania w 1990 i 1992 przeprowadził Kierulff. Stwierdził on obecność marmozet lwich w trzech regionach: w okolicy Centro Hípico de Cabo Frio nieopodal wybrzeża, w Poço das Antas Biological Reserve i przyległych lasach, na wzgórzach Serra do Mar. Obliczył on powierzchnię zasięgu małpy na 104,5 km². Izolowane populacje odnotowano w Silva Jardim, Cabo Frio, Saquarema i Aruarama[2]. Kolejne badania, przeprowadzone przez wspomnianego naukowca (1993), a także przez Ballou (1997), wykazały istnienie czterech dużych izolowanych od siebie populacji zamieszkujących: Poço das Antas Biological Reserve i tereny przyległe, Encosta da Serra, Centro Hípico oraz Campos Novos[12]. W 2007 Burity doniósł o zamieszkiwaniu przez marmozetę lwią Parku Narodowego Taquara Municipal w okolicy Duque de Caxias[2].
Lokalizacja typowa, ustalona w 1986, znajduje się na brazylijskim wybrzeżu, pomiędzy 22 a 23°S, od Cabo de Sãbo Tomé do Mangaratiba. W 1965 została przez Carvalho ograniczona do prawego brzegu Rio São João[3].
Gatunek nie odbywa migracji. Kontakty między populacjami są utrudnione z uwagi na rozdzielające lasy miasta, tereny uprawne i pastwiska. Kierulff i Oliveira w 2004 opisali wędrówkę dwóch osobników – samca i samicy – z lasu dwudziestohektarowego do mniejszych lasów o powierzchni odpowiednio 5 ha i 1 ha. Naczelne miały do przemierzenia średnio 1 km, musiały pokonać po drodze pastwiska. Samca znaleziono martwego po 15 dniach, przyczyn jego śmierci upatrując w zagryzieniu przez psa. Samicę najprawdopodobniej schwytał handlarz zwierząt[12].
Pokarm tego wszystkożernego gatunku naczelnych stanowią przede wszystkim owoce i nasiona[13], a także kwiaty, nektar, żywicę, płazy bezogonowe, ślimaki, jaszczurki, pająki i owady. Długie palce pozwalają im szperać w wąskich szczelinach, a także w zbiornikach wodnych utworzonych w kątach liści roślin z rodziny ananasowatych[2].
W grupach obserwowanych w niewoli stwierdzono przepływ pokarmu pomiędzy osobnikami, mogący zachodzić na drodze podarku lub kradzieży. Ten pierwszy z wymienionych sposobów odgrywa rolę głównie w przypadku rodziców i ich potomstwa oraz dzielenia żywej zdobyczy. Wymaga on specjalnych sygnałów. Z pożywienia zdobytego przez inne osobniki korzystały samce w wieku przed kopulacją, samice w zaawansowanej ciąży lub noszące młode, potomstwo odstawiane od piersi, osobniki młodociane[19].
Do drapieżników polujących na reintrodukowane Leontopithecus rosalia zalicza się ocelota i zdziczałego psa domowego[20].
Marmozety zamieszkują tereny nizinne, położone blisko oceanu, nie sięgające wyżej niż 300 m n.p.m. Porasta je nizinny okresowy las deszczowy. Tereny te cechują znaczne opady – 1500 mm rocznie[2]. Wedle informacji z 1983 małpa żyje w lasach tropikalnych, w których dominują rośliny z rodzajów Ficus, Inga, Platymenia i gatunek Tapirira guianensis[7].
Opisywany przedstawiciel naczelnych dobrze radzi sobie w środowisku zdegradowanym i zmodyfikowanym działalnością ludzką. Wymaga jedynie całorocznych źródeł pożywienia i dziupli służących za schronienie[2].
IUCN przyznaje marmozecie lwiej status gatunku zagrożonego wyginięciem (endangered – EN). Pierwotnie za zagrożony uznali go w 1982 Thornback i Jenkins, a opinia w kolejnych opracowaniach IUCN nie zmieniała się aż do 1994 włącznie. Jednakże w 1996 zdecydowano się zmienić status na krytycznie zagrożony (CR – critically endangered), co nie uległo zmianie w XX wieku. Dopiero w 2003 powrócono do statusu EN[2].
Cytowane już badania, opublikowane w 1993 i w 1997 wykazały istnienie czterech dużych izolowanych od siebie populacji zamieszkujących: Poço das Antas Biological Reserve i tereny przyległe, liczącej 420 zwierząt, Encosta da Serra, 74 małpy, Centro Hípico, tylko 29 osobników, oraz Campos Novos, 36 marmozet. Te 4 populacje obejmowały 90% liczebności gatunku. Prócz nich istniało jeszcze 12 małych populacji[12].
Trend populacyjny jest stabilny[2].
Niegdyś wśród głównych zagrożeń dla tego ssaka wymieniało się utratę środowiska naturalnego i odławianie przez człowieka w celu trzymania jako zwierzę domowe i handlu. Utratę habitatu IUCN wiąże głównie z wylesianiem. Wedle danych tej organizacji deforestacja w stanie Rio de Janeiro rozpoczęła się już w XVI wieku, powodowana zakładaniem plantacji trzciny cukrowej i kawy. W ostatnim stuleciu ważniejsze przyczyny widzi w hodowli bydła, pozyskiwaniu drewna i węgla drzewnego oraz urbanizacji. Obecnie zwraca się uwagę głównie na niewielkie możliwości rozwoju w zdegradowanych, rozdrobnionych lasach[2].
Cytowana organizacja podnosi temat ograniczonego zasięgu występowania małpy. W badaniach Kierulffa w okolicy Centro Hípico de Cabo Frio stwierdzono 36 osobników, w okolicach Poço das Antas Biological Reserve (5500 ha, w tym 2760 porośnięte lasem) dziesięciokrotnie więcej, w Serra do Mar zaś 74 sztuki. Prócz tego doliczono się w sumie sześćdziesięciu zwierząt w 9 innych miejscach, tworzących 12 izolowanych populacji. W sumie na początku lat dziewięćdziesiątych przeprowadzono dokładne badania liczebności gatunku. Starsze wyniki szacowały liczebność marmozety lwiej na 200-600 zwierząt. Naliczono więc 272 osobniki w 55 grupach, pomijając te zamieszkujące Poço das Antas Biological Reserve (w którym żyło wtedy około 290 osobników). Wyróżniono wtedy 4 główne populacje po co najmniej 6 grup każda oraz 12 grup izolowanych zamieszkujących fragmenty lasu o powierzchni nieprzekraczającej 200 ha. Większość z grup (29, czyli 53% wszystkich) zamieszkiwało Silva Jardim. Natomiast w Cabo Frio doliczono się 24. Zarówno w Saquarema, jak i w Araruama odnotowano istnienie pojedynczej grupy. Całkowita liczebność gatunku wyniosła 562 małpy. Wtedy też całkowity zasięg występowania gatunku oszacowano na 104,5 km². Gęstość osobników na jednostkę powierzchni wyniosła w Poço das Antas w 1994 12 osobników/km² (1,96 grupy/km²), w otaczających rezerwat lasach w 1993 odpowiednio 5,1 osobnika i 1,17 grupy na km², w União Biological Reserve (3260 ha, z czego 2400 zalesione) 3,5 osobnika i 0,46 grupy w 2000, zaś w Campos Novos 8,5 osobnika i 2,35 grupy na km² w 1993. W 2000 liczba marmozet lwich w Poço das Antas zmniejszyła się do 220 na skutek drapieżnictwa. Prócz tego szerokonosa występuje również w Bacia do Rio São João / Mico-leão-dourado Environmental Protection Area (150700 ha) i Taquara Municipal Natural Park (19000 ha)[2].
Obecnie liczebność marmozety lwiej szacuje się na ponad 1000 małp. Jednakże Seal et al. (1991) oraz Ballou et al. (1998) twierdzą, że minimum dla przetrwania gatunku to 2000 osobników. Tymczasem lasów odpowiednich dla dalszego zasiedlania przez te pazurkowce jest niewiele[2].
Małpom zagrażają dzisiaj ludzie, drapieżniki, brak pokarmu, choroby[20] i pożary lasu. Zamieszkiwany przez nie pas atlantycki kiedyś obejmował powierzchnię miliona km², rozpościerając się od wschodniej Brazylii aż do Paragwaju i Argentyny. Szacuje się, że na początku XXI wieku (2001) zostało z tego od 1 do 5%[12]. Tylko jedna piąta dawnego zasięgu występowania małpy jest w dalszym ciągu porośnięta lasem, z czego 60% wykazuje silne rozdrobnienie: kępy lasu nie przekraczają powierzchni 1000 ha, a 96% z nich nawet 100 ha[2]. Destrukcję środowiska naturalnego uważa się za jeden z dwóch najważniejszych, prócz odłowów prowadzonych przez człowieka, powodów spadku liczebności naczelnych tego obszaru. Z drugiej strony populacja wykazuje utratę heterozygotyczności, jest zagrożona chowem wsobnym[12]. Dietz ze współpracownikami w 2000 opublikowali analizę populacji liczących do 50 naczelnych, szacując, że chów wsobny zmniejsza prawdopodobieństwo przetrwania o ⅛[2].
Liczne organizacje wykazują zainteresowanie sprawą marmozety, istnieją plany jej ochrony. IUCN wymienia tutaj m.in. Golden Lion Tamarin Conservation Program (GLTCP) rozpoczęty w 1983 przez Smithsonian National Zoological Park z siedzibą w Waszyngtonie[2].
Zwierzę zamieszkuje następujące tereny chronione: wspomniane już Reserva Biológica Poço das Antas oraz Reserva Biológica União[12]. Dzięki reintrodukcji ochroną objęto 3100 ha lasu w obrębie zasięgu występowania L. rosalia. Prócz tego naczelny figuruje na Lista Oficial de Espécies Brasileiras Ameaçadas de Extinção z 1989 (oficjalna brazylijska lista gatunków zagrożonych wyginięciem) oraz na regionalnej liście gatunków zagrożonych stanu Rio de Janeiro. Obejmuje go również załącznik I Konwencji o międzynarodowym handlu dzikimi zwierzętami i roślinami gatunków zagrożonych wyginięciem[2].
Działania zmierzające do ratowania gatunku zaczęto od stworzenia programu rozmnażania w niewoli. Rozpoczął się on w późnych latach sześćdziesiątych XX wieku. Brali w nim udział Adelmar Coimbra-Fillho i Alceo Magnanani. Program międzynarodowy powstał w następnej dekadzie, w 1972, dzięki Kleimanowi. Nadano mu nazwę The Golden Lion Tamarin Conservation Program. Działa on cały czas, głównie w Poço das Antas, obejmując nie tylko rozród w niewoli, ale także badania terenowe, reintrodukcję, edukację i przywracanie środowiska naturalnego. Poza tym w 1990 rząd Brazylii założył Instituto Chico Mendes de Conservação da Biodiversidade przy brazylijskim Ministerstwie Ochrony Środowiska, czyli International Committee for the Conservation and Management of lion Tamarins[2].
Zauważono jednak problemy z rozmnażaniem się gatunku w niewoli[15].
Podejmowane są próby reintrodukcji. Małpy urodzone w niewoli wykazują problemy z lokomocją, orientacją i poszukiwaniem pożywienia. Zespół Becka pomiędzy 1984 a 1991 wypuścił na wolność 91 osobników (z czego 85 urodzonych w niewoli). W 1991 pisze o 36, które przetrwały. Daje to przeżywalność 67% zwierzętom urodzonym na wolności i tylko 34% od narodzin hodowanym przez człowieka. Reintrodukowane marmozety wydały na świat 67 młodych, spośród których przetrwało 38, przy czym urodzone na wolności dzieci zwierząt, które przyszły na świat w niewoli, radziły sobie lepiej od pokolenia rodziców[20].
Zwierzętom reintrodukowanym zagrażają w największym stopniu schwytanie przez ludzi (6 małp w badaniu Becka) oraz drapieżnictwo ze strony ptaków i ssaków (w sumie 6). W następnej kolejności wymienia się głód, po nim zaś następują letarg, odwodnienie, niedożywienie, biegunka (występujące wspólnie, 4 małpy) oraz hipotermia (4 małpy), jeszcze dalej zaś konflikty społeczne (3), użądlenia przez błonkówki (Apis mellifera scutellata), zatrucia owocami (Hyperbaena domingensis), ukąszenia przez węże (po 2, pierwsza marmozeta nadepnęła węża, druga próbowała wedle autora spożyć koralówkę arlekina[20], chociaż ten akurat gatunek z rodziny zdradnicowatych zamieszkuje Amerykę Północną[21]), na samym końcu krwotok po poronieniu i uraz głowy (pojedyncze osobniki). W przypadku marmozet urodzonych na wolności cytowany badacz odnotował tylko 2 porwania przez ludzi i jedno użądlenie. Opisuje on też uratowanie dwóch osobników siedzących na ziemi, z temp. 30 °C po zimnej nocy, jak również sterydoterapię samca z 27 użądleniami Apis mellifera scutellata. Zwykle marmozety unikają pszczół[20].
Podejmowane są też próby reintrodukcji zwierząt do nowo tworzonych obszarów chronionych, jak Reserva Biológica União. Umieszczono w nim 47 osobników z populacji niemających szans na przetrwanie w poprzednich miejscach swego pobytu, w niewielkich, rozdrobnionych lassach[2].
Wedle Kierulffa w 1993 populacja zwierząt reintrodukowanych obejmowała 118 zwierząt, natomiast 7 lat później liczyła ona 359 osobników. Dawne docelowe miejsca reintrodukcji rozważa się już w kontekście odłowu marmozet. Szacuje się bowiem na przykład, że Reserva Biológica União może utrzymać najwyżej 158 L. rosalia[2].
Obecnie planom reintrodukcji podlega jedna trzecia całkowitej populacji[2].
W przyszłości wedle IUCN działania mające na celu dalszą poprawę sytuacji gatunku powinny skupić się na zalesianiu i tworzeniu korytarzy[2].
Marmozeta lwia (Leontopithecus rosalia) – gatunek południowoamerykańskiej małpy szerokonosej. Zamieszkuje lasy deszczowe południowo-wschodniej Brazylii. Zasięg występowania gatunku jest ograniczany z powodu fragmentacji i zmniejszania areału lasów. Żyje w grupach rodzinnych zbudowanych wokół samca i samicy. Tworzy zwykle małe populacje, zagrożone chowem wsobnym. Spożywa pokarm roślinny i zwierzęcy. Podlega ochronie i poddawany jest reintrodukcji.
O mico-leão-dourado (nome científico: Leontopithecus rosalia) é um primata endêmico do Brasil, da família Callitrichidae e gênero Leontopithecus. Ocorre exclusivamente na Mata Atlântica brasileira, no estado do Rio de Janeiro, mas alguns autores já consideraram sua ocorrência no sul do Espírito Santo. Atualmente, são encontrados principalmente na Reserva Biológica Poço das Antas e na Reserva Biológica União, e vivem nos estratos mais altos da floresta. Podem ser encontrados em trechos de floresta secundária. Já foi considerado como uma subespécie, hoje é uma espécie propriamente dita, como as outras espécies de micos-leões. Evidências de estudos filogenéticos mostram que o mico-leão-preto é a espécie mais próxima do mico-leão-dourado. Não existem fósseis conhecidos da espécie.
Junto com outros micos-leões é o maior membro da subfamília Callitrichinae, podendo pesar até 800g. A pelagem varia do dourado ao alaranjado com uma juba muito característica, que lhe conferiu o nome popular. Apresenta garras em vez de unhas e o terceiro dedo da mão é muito longo e usado para procurar presas. O dimorfismo sexual não é acentuado. O crânio é pequeno e menos robusto, se comparado com outros micos-leões. Possui 30 dentes, sendo os incisivos muito semelhante a caninos.
São animais diurnos e muito ativos durante as primeiras horas da manhã. Os comportamentos sociais são muito semelhantes a de outros primatas. Vivem em grupos de até 9 indivíduos, organizados em grupos familiares, sendo comum a poliandria. A poliginia pode ocorrer em menor proporção. Os territórios variam em tamanho, podendo ter até 217 hectares de área. A fragmentação do habitat fez com que muitos territórios se sobreponham sobre de outros. São animais onívoros, se alimentando de frutos, invertebrados e pequenos vertebrados na estação chuvosa e de néctar na estação seca. Tem um repertório variado de vocalizações, que são emitidas em contextos específicos. Dão à luz a gêmeos, depois de uma gestação de 130 dias. Os machos ajudam com o cuidado na prole, assim como crias de anos anteriores.
É uma espécie que corre risco de extinção, listada como espécie em perigo tanto pela IUCN quanto pelo ICMBio. Ocorre quase que exclusivamente na Reserva Biológica Poço das Antas, na Reserva Biológica União e em fragmentos florestais nos arredores, na bacia do rio São João, no estado do Rio de Janeiro. Existem cerca de 3 200 indivíduos em liberdade, graças a inúmeros esforços na conservação e reprodução da espécie. As populações em cativeiro são relativamente numerosas e estáveis. O mico-leão-dourado é uma espécie bandeira na conservação da Mata Atlântica brasileira.
O mico-leão-dourado também é conhecido simplesmente por mico-leão,[nota 1], por saguipiranga e sauimpiranga.[4] "Mico" deriva do caribe continental miko.[4] "Saguipiranga" e "sauimpiranga" vêm do tupi sa'wi pi'rãga, que significa "sagui vermelho".[4] O nome "mico-leão-dourado", em específico, surgiu quando um espécime foi levado para Paris para Madame de Pompadour, em 1754, e descrito por M.J. Brisson como le petit singe-lion, que literalmente significa: "o pequeno mico-leão".[5] Mico-leão é uma alusão aos pelos da cabeça, que acabam por formar uma juba como de um leão.[6]
O mico-leão-dourado pertence ao gênero Leontopithecus, grupo monofilético da família Callitrichidae.[2] Foi descrito por Carl Linnaeus, em 1766.[1] O gênero Leontopithecus foi proposto por Hershkovitz (1977) como monotípico, sendo Leontopithecus rosalia a única espécie: o mico-leão-dourado era uma subespécie (L. r. rosalia), junto com o mico-leão-preto (L. r. chrysopigus) e mico-leão-de-cara-dourada (L. r. chrysomelas).[2][7] [nota 2] Essa classificação foi revisada, e atualmente, é considerado, junto com as outras espécies de micos-leões, uma espécie propriamente dita.[1][2][3][8]
Evidências genéticas apontam para um período muito recente de diversificação dos micos-leões, a partir de refúgios de floresta no Pleistoceno.[9] A espécie mais aparentada ao mico-leão-dourado é o mico-leão-preto, que provavelmente compartilhou um ancestral que possuía pelagem escura.[10][11][12][13]
Não foi encontrado nenhum fóssil da linhagem do mico-leão-dourado.[14]
Relações filogenéticas do mico-leão-dourado (Leontopithecus rosalia).[13]Leontopithecus rosalia
Originalmente, o mico-leão-dourado era encontrado nas florestas de terras baixas (até 300 m de altitude) na bacia do rio São João, no Rio de Janeiro.[15][16] Vários autores já consideraram a ocorrência do mico-leão-dourado no Espírito Santo, mas o primatólogo Adelmar Faria Coimbra-Filho admitiu que não havia dados suficientes para concluir que ele de fato existiu nesse estado.[15] No século XIX, era encontrado em florestas perto de Cabo Frio, especialmente nas margens da lagoa de Araruama e no município de Maricá, ocorrendo nessas localidades até a década de 1940.[16] Alguns autores já citaram que o mico-leão-dourado podia ser encontrado no litoral do estado de São Paulo, mas nunca foi reportada sua presença oficialmente.[16]
O habitat está localizado em região de clima quente e úmido, com precipitações de até 1500 mm anuais, com uma estação seca.[16] Ocorre em ambientes de floresta, principalmente ao longo de cursos d'água permanentes.[16] Prefere ficar na copa das árvores, entre três e 10 metros de altura.[16] Pode ser encontrado em fragmentos de floresta secundária.[16]
Atualmente, é encontrado apenas em alguns remanescentes de floresta da bacia do rio São João, principalmente na Reserva Biológica Poço das Antas e na Reserva Biológica União.[3][16] Fragmentos de floresta em Silva Jardim, Cabo Frio, Saquarema e Araruama apresentam populações da espécie, e ela foi reintroduzida com sucesso nos municípios de Rio das Ostras, Rio Bonito e Casimiro de Abreu.[17][18] Recentemente, foi reportada uma população em Duque de Caxias, sendo a população mais ao sul conhecida atualmente.[19]
O mico-leão-dourado possui toda a pelagem de cor ruiva a dourada, o que conferiu o nome popular, e possui uma juba derivada de pelos que saem das bochechas, cabeça, pescoço e cobrem as orelhas.[6][14] Acredita-se que essa cor de pelagem deva-se à ingestão de carotenoides e à exposição à luz solar: observa-se em alguns animais em cativeiro, uma coloração mais clara, e provavelmente isso se deve a dieta deficitária em carotenoides.[14][20] Os pelos são trocados gradativamente, uma vez ao ano, principalmente na estação chuvosa.[21] Fêmeas grávidas perdem menos pelos no período da troca.[21] A face é negra, quase nua. Tem 26 cm de comprimento sem a cauda e pesa 620 g em média.[22] Animais criados em cativeiro podem chegar até 800 g, o que representa o maior tamanho entre os Callitrichinae.[23]
Tem uma taxa metabólica menor do que esperado para um animal de seu tamanho, mas ainda é maior que muitos primatas noturnos com hábitos alimentares semelhantes.[23] A temperatura corporal varia de forma significativa entre 39 °C de dia, e 37,4 °C à noite.[23] Existe órgão vomeronasal, que em indivíduos subadultos é tão desenvolvido quanto em Strepsirrhini.[24] No adulto, o epitélio sensorial desse órgão é entremeado por porções não sensoriais, contrastando com o órgão vomeronasal de Callithrix jacchus e se assemelhando ao de Saguinus geoffroyi.[24]
A glande do pênis é em formato esférico, e existem papilas cobrindo o corpo do pênis.[14] Os testículos podem estar dentro do escroto (que não é pigmentado e pode ter até 18 mm de diâmetro), ou em posição inguinal, e parece haver um controle voluntário dessas posições.[14] O báculo é um dos mais especializados entre os calitriquíneos e tem até 3 mm de comprimento por 0,9 mm de largura.[14] A vulva é pouco proeminente e não pigmentada, e os grandes lábios não são tão diferenciados como em outros membros da subfamília.[14] O clitóris compartilha características com de outros primatas, sendo atravessado por um sulco ventro-medial, sensivelmente destacado e séssil, com uma glande dividida ao meio.[25] Como em outros membros da subfamília Callitrichinae, o clitóris é pequeno se comparado com outros primatas sul-americanos, como os cebíneos e atelídeos.[25] As glândulas mamárias são duas, e estão no peito, em posição axial, perto da linha média do corpo.[14]
Possui mãos e dedos muito longos, com unhas que lembram garras que são usadas para procurar pequenos vertebrados e artrópodes em orifícios e fendas estreitas, como os espaços entre as folhas de bromélias: o dedo do meio é longo a ponto de ser quase duas vezes mais comprido que a palma da mão.[26][27][14] Essa característica nas mãos permite que o mico-leão-dourado agarre-se nos ramos das árvores, apresentando uma locomoção completamente quadrúpede enquanto se movimenta na vegetação.[22] Entretanto, isso é observado mais em cativeiro, ao passo que em estado selvagem, o mico-leão-dourado acaba sendo mais um escalador, se movimentando em ambientes verticalizados. Ademais, os quatro membros possuem mais ou menos o mesmo comprimento, o que é diferente dos outros calitriquíneos, o tornando também, menos saltador e mais escalador em sua locomoção.[14] Não possui dimorfismo sexual, apesar dos machos tenderem a ser maiores.[22] Em cativeiro foi constatado que podem viver até 14,2 anos.[22]
A morfologia do crânio e dos dentes do gênero Leontopithecus já foi descrita e serviu como base para filogenias do gênero.[28] O mico-leão-dourado possui crânio pequeno e maxilas pouco proeminentes, se comparado aos outros micos-leões.[29][28] Também possui a face mais ampla que do mico-leão-de-cara-dourada e o mico-leão-preto.[30] Apesar disso, a caixa craniana é do mesmo tamanho que do mico-leão-de-cara-dourada, medindo cerca de 28,46 mm de comprimento.[28] As medidas morfométricas, principalmente na região da face, são diferentes entre macho e fêmea do mico-leão-dourado (cerca de 41% das medidas são diferentes), e os machos tendem a ter maiores medidas que as fêmeas, com exceção da largura das órbitas (13,32 mm para as fêmeas e 13,2 mm, para os machos).[31] O crânio do macho de mico-leão-dourado tem até 57,52 mm de comprimento, enquanto a fêmea possui 55,66 mm.[31] A mandíbula tem um formato intermediário entre o "V" do gênero Callithrix e o "U" do gênero Saguinus, e mede 33,19 mm no macho e 32,40 mm na fêmea.[14][31] O processo coronoide é grande e em formato de gancho.[32]
Tem 32 dentes, com fórmula dentária de 2.1.3.2 2.1.3.2 × 2 = 32 {displaystyle { frac {2.1.3.2}{2.1.3.2}} imes 2=32} 
O mico-leão-dourado possui 46 cromossomos, sendo o cromossomo Y e 14 autossomos, acrocêntricos, e o restante, incluindo o cromossomo X, possuem dois braços.[35] O cariótipo é muito parecido com o observado no gênero Saguinus e idêntico ao do mico-leão-de-cara-dourada: as diferenças entre os táxons se dão por rearranjos diferentes nas bandas observadas nos cromossomos.[35] Foi observado quimerismo em células XX/XY o que frequentemente é descrito nos representantes da subfamília Callitrichinae.[35] Apesar da semelhança com Saguinus, os mico-leões são mais próximos aos saguis do gênero Callithrix pela análise morfológica dos cromossomos.[36]
Foram identificados cinco lócus de microssatélites, sendo que quatro são polimórficos.[37] Apesar de nenhuma das populações livres analisadas por Gravitol et al (2001) não conterem todos os alelos por lócus analisado, e a heterozigose ter sido baixa (principalmente em populações pequenas), existe uma grau de variabilidade genética nas populações selvagens, pois todas apresentaram polimorfismos em todos os lócus.[37] Ademais, as populações analisadas neste trabalho foram significativamente divergentes entre si, o que pode ser um efeito da fragmentação do habitat e isolamento dessas populações entre si.[37]
Os micos-leões são animais diurnos, sendo mais ativos nas primeiras horas da manhã.[38] Utilizam principalmente buracos em troncos de árvore como sítios de dormida, que mudam diariamente, e eventualmente podem utilizar copas de palmeiras.[39][40] Esses sítios de dormida se localizam preferencialmente entre 11 e 15m de altura.[40]
Passam boa parte do tempo (cerca de 33%) do dia se locomovendo pelo território, usando, geralmente, cerca de 50% dele em suas atividades diárias.[39] O deslocamento médio diário varia entre 1 465 a 2 135 m na Reserva Biológica União.[41]
Possuem um repertório limitado de expressões faciais, como os outros macacos Neotropicais, e vocalizações e sinais odoríferos possuem papel importante na comunicação entre os indivíduos.[20] Costumam ser bastante agressivos com indivíduos que não são do mesmo grupo, e interações agonísticas não são frequentes em grupos estáveis, a menos que existam fêmeas no estro.[14] Um dos sinais de conflito entre mico-leões é a exibição do arch display, que é quando um animal arqueia o dorso numa postura quadrúpede, parecendo maior do que é: essa postura não tem uma natureza necessariamente agressiva e parece regular o contato social, de forma a evitar agressão propriamente dita.[42] Em cativeiro, a agressão entre membros do mesmo grupo é um problema, principalmente quando há a inclusão de animais novos.[43] Machos jovens são os maiores alvos de ataques, e os agressores podem ser outros machos jovens, fêmeas jovens e adultos.[43] Nota-se que machos adultos raramente iniciam ataques a membros do mesmo grupo.[43]
A catação é frequente, e é como observada em outros primatas, com as mãos sendo utilizadas para afastar e puxar o pelo de outro indivíduo.[38] Machos costumam cheirar as fêmeas com frequência, principalmente na região ano-genital, quando estas estão no cio.[38]
Dentre os predadores do mico-leão-dourado, aves de rapinas e a jaguatirica, são exemplos, conhecidos por predarem calitriquíneos.[44][45] Cães também são conhecidos predadores, assim como cobras (principalmente jibóias) e corujas (que predam filhotes ao acessarem seus ninhos).[45] O risco de predação por animais noturnos em abrigos é preponderante no comportamento pouco chamativo dos mico-leões antes de irem dormir.[46] Recentemente, foi observado que a maior parte dos micos-leões predados são animais reintroduzidos, e provavelmente, inexperientes quanto às estratégias de fuga e esquiva de predadores.[45] Além disso, o grau de desmatamento de seu habitat tornou os micos-leões mais susceptíveis à predação, principalmente por animais domésticos.[46]
O mico-leão-dourado é relativamente livre de ectoparasitas, provavelmente devido à catação, tanto social, quanto solitária.[47] Geralmente, são encontrados carrapatos: foram registradas formas imaturas de três espécies do gênero Amblyomma em micos-leões da Reserva Biológica Poço das Antas e duas da família Trombiculidae.[47] Microtrombiculida brennani foi um espécie de trombiculídeo descrita no mico-leão-dourado, assim como outra espécie da mesma família, Speleocola tamarina.[48][49] Uma espécie de ácaro de folículo foi encontrada também: Rhyncoptes anastosi.[47]
Foi constatado a presença de parasitas no trato gastro-intestinal em animais em liberdade nas reservas de Poço das Antas e União, principalmente acantocéfalos do gênero Oncicola (prevalência de até 30%), e duas famílias de nemátodos: Spiruridae e Trichostrongylidae.[50] As fêmeas são mais infestadas por esses vermes do que os machos.[50] Outros helmintos, com uma prevalência menor nessas unidades de conservação foram constatados: nemátodos das famílias Ancylostomatidae e Ascarididae e a espécie Tripanoxyuris minutus (um Oxyuridae).[50]
Trypanosoma cruzi (causador da doença de Chagas em humanos) infecta os micos-leões da Reserva Biológica de Poço das Antas (com prevalência relativamente alta), mas aparentemente, tal infecção não apresenta sinais clínicos.[51][52] Nota-se, em áreas fora da Reserva Biológica em questão, que a prevalência de indivíduos infectados com T. cruzi é menor.[52] Outros protozoários, como Toxoplasma gondii, conhecido por parasitar saguis, infecta animais em cativeiro na América do Norte e Europa.[53] A infecção por esse protozoário pode ser fatal. Amebíase e giardíase também são doenças que afetam micos-leões.[53]
São animais frugívoros e insetívoros, se alimentando principalmente de pequenos frutos macios, artrópodes e pequenos vertebrados.[39][40] Entre 10 a 15% de sua dieta é composta por insetos.[40] Os micos-leões exploram bastante os microhabitats dentro das bromélias para encontrar insetos e pequenos vertebrados utilizando suas garras e longos dedos para explorar tais ambientes.[16][39] Na estação seca, é comum substituírem parte da dieta por néctar, quando diminui a disponibilidade de frutos maduros.[39][40]
Na Reserva Biológica Poço das Antas foram constatadas até 64 espécies de plantas que são consumidas pelo mico-leão-dourado.[39] Durante a estação seca, o néctar de Symphonia globulifera foi largamente utilizado.[39] Outras fontes de néctar são de plantas epífitas como Combretum fruticosum e Monstera sp.[39] Esse padrão de alimentação também foi constatado na Reserva Biológica União.[41] Os frutos são geralmente pequenos e macios, como de Miconia candolleana e de Ficus sp, sendo que frutos maiores, como os de Genipa americana são consumidos de forma ocasional.[39] Durante a estação seca, frutos não maduros de Euterpe edulis, comuns em florestas pantanosas, são ingeridos largamente.[39] Na Reserva Biológica União, plantas da família Myrtaceae, Sapotaceae, Melastomataceae e Rubiaceae têm importância na dieta dessa espécie de mico-leão, sendo responsáveis por até 41% das espécies consumidas.[41] Nesse mesmo ambiente, foi visto que o peso médio dos frutos ingeridos é de 5,6 g e 21,9 mm de comprimento, possuem casca macia, e em sua maior parte, eram coloridos.[41] Os mico-leões acabam por ingerir quase tudo do fruto, inclusive as sementes na maior parte dos casos, e é considerado um bom dispersor de sementes, já que as espécie ingeridas germinam, mesmo que em baixas proporções.[41][54] Entretanto, Lapenta et al (2008) considera que o mico-leão beneficia algumas espécies e prejudicam outras, não apresentando um efeito consistente na germinação final de sementes.[54] Outro estudo já aponta para um papel preponderante do mico-leão-dourado na regeneração da floresta, visto sua eficiência em dispersar sementes a uma distância considerável.[55]
Dentre os itens de origem animal, ovos, pequenos vertebrados, como sapos (do gênero Hyla e Dendrophryniscus brevipollicatus) e filhotes de pássaros, artrópodes e até mesmo caracóis, fazem parte da dieta do mico-leão-dourado.[39] Essas presas são geralmente procuradas entre bromélias e folhas de palmeiras, que são abundantes em florestas pantanosas.[39] A procura é feita com as mãos, principalmente com o dedo mais longo.[44] O consumo de presas é maior durante a estação chuvosa, mas a distribuição e abundância de microhabitats onde podem encontrar presas são preponderantes na busca que esses animais realizam por itens de origem animal.[41]
O mico-leão-dourado é tradicionalmente tido como monogâmico, embora alguns estudos mostrem que a poliandria é relativamente frequente em liberdade (cerca de 40%).[38][56][nota 3] A poliginia pode ocorrer também, mas em menor porcentagem (apenas 10%).[57] Neste caso, geralmente, o grupo de fêmeas é composto por uma fêmea mais velha (a mãe) e fêmeas mais novas (filhas), e a fêmea mais velha é a dominante.[57] Se as fêmeas não são parentes, a dominância é conseguida através de comportamentos agonísticos.[57] Na poliandria existe uma relação hierárquica entre os machos do grupo, que podem competir pelas cópulas.[56] Frequentemente, o bando possui dois machos, sendo que o macho dominante possui altas concentrações plasmáticas de andrógenos: interessante notar, que se o macho subordinado for um parente do dominante, não é observado uma concentração menor de andrógenos no subalterno, ao passo que isso é reportado em animais subordinados não parentes ao dominante.[58]
A hierarquia entre os machos é sinalizada por meio de marcação de cheiro.[59] Ela não parece ser utilizada para demarcar território, embora sirva para marcar locais em que se encontram recursos alimentícios.[59] As fêmeas-alfa a utilizam para se comunicar com membros de outros grupos, o que não é observado entre os machos.[59] Os bandos possuem entre 2 e 8 membros, e eles costumam abandoná-los quando atingem a maturidade sexual, saindo acompanhados de um ou mais dois irmãos do mesmo sexo.[57][60] Quando saem do grupo, os machos têm a possibilidade de se tornarem dominantes ao ocupar a vaga de um dominante morto de outro bando.[60] Já a imigração das fêmeas é pouco frequente, que não são somente perseguidas e agredidas pelas fêmeas de outro bando, mas também por machos: deve-se salientar que é difícil a incorporação de fêmeas flutuantes[nota 4] em grupos estáveis, o que não ocorre com os machos.[60][61] As fêmeas, ademais, podem "herdar" a posição de alfa da mãe, o que aumenta as possibilidades delas continuarem no grupo, algo que não ocorre com os machos quando o dominante do bando em que nasceram morre.[60] Entretanto, a "decisão" de uma fêmea dominante e reprodutora permitir a permanência de outra no grupo parece influenciada pela disponibilidade de recursos no ambiente, visto que é mais frequente bandos poligínicos em florestas pantanosas, onde existe maior quantidade de alimento.[57] Sendo assim, a monogamia ou poliandria é devido mais à competição entre fêmeas e suas restrições sobre os machos do que uma preferência desses últimos pela monoginia.[61] [nota 5] Além disso, associações entre machos são mais duradouras e estáveis do que associações entre fêmeas, o que favorece a poliandria e um cuidado parental compartilhado entre os machos.[61]
Cada grupo habita um território entre 21,3 e 73 hectares, como mostrado em estudos na Reserva Biológica Poço das Antas.[39] Tal variação na área de vida está diretamente relacionada à quantidade de alimento no ambiente em que vivem.[39] Na Reserva Biológica União, a área de vida é um pouco maior, possuindo em média, 109,2 hectares (variou entre 68 a 217 ha).[41] É provável que essas diferenças estejam relacionadas à diferenças de produtividade entre as duas unidades de conservação, e na Reserva Biológica União, existe sobreposição nos territórios dos grupos.[41] Trata-se também das maiores áreas de território entre os calitriquíneos, e parece vantajoso que os mico-leões sejam territoriais, visto que seus recursos alimentares são relativamente raros no ambiente em que vivem.[62] Isso se reflete no tempo que o grupo de mico-leão passa em áreas fronteiriças do território, que apesar de serem menos abundantes em alimento, faz com que o bando passe muito tempo patrulhando os limites de sua área de vida, para evitar a entrada de intrusos.[62] Observou-se que o sistema de acasalamento não influencia muito no tamanho do território, já que grupos monogâmicos ou poligínicos possuem mesmo tamanho de território.[57] Entretanto, o tamanho do território de grupos contendo fêmeas reprodutoras é maior do que aqueles em que não possuem nenhuma.[57]
As vocalizações desempenham um papel importante na comunicação entre os calitriquíneos, visto as inúmeras limitações visuais impostas pelo ambiente que vivem.[20] As vocalizações do mico-leão-dourado são complexas e divididas em quatro tipos estruturais: "cacarejos", "ganidos", "trinados" e sons não-tonais, com vários componentes ultra-sônicos.[20] Não há diferenças com relação à idade, sexo e entre grupos no uso de tais vocalizações.[63] Tais vocalizações são emitidas em contexto ecológicos específicos e poucas são emitidas em encontros sociais: os "cacarejos" são comuns durante o forrageamento, os "ganidos" ocorrem frequentemente em atividades locomotoras em grupo pelo território ou quando existe um grupo muito próximo, os "trinados" são comuns quando os animais estão saltando.[63] Acredita-se que muitas vezes essas vocalizações sinalizam estados de excitação nos determinados contextos, como quando indivíduos estão prestes a compartilhar comida.[20] Existem vocalizações com tempo de duração longo, as "chamadas de longa distância", que são vocalizações comuns em contextos de defesa de território.[20] Estudos referentes aos aspectos acústicos de tais chamadas sugerem que elas evoluíram primariamente dentro de contextos de comunicação intragrupo e depois passaram a ser utilizadas na territorialidade.[64] A estrutura dessas vocalizações também é diferente das outras espécies de micos-leões, mas é semelhante a do mico-leão-preto, que possui notas de longa duração e relativamente baixa intensidade.[65][nota 6] Ao contrário do que se suponha baseado em outros calitriquíneos, é possível diferenciar quais vocalizações são emitidas por machos ou fêmeas, com exceção dos "trinados".[66]
Com base nos intervalos entre o acasalamento e o nascimento das crias, calculou-se que a média da gestação é de cerca de 129 dias.[20] O ciclo estral é de 19 dias, sendo o menor dentre os Callitrichinae.[67] As fêmeas não possuem sinais óbvios para os machos de que estão no período fértil, e possivelmente, isso tem relação com o sistema de acasalamento poliândrico ou monogâmico dos micos-leões.[68] Nota-se, que pares recém-formados apresentam atividade sexual 2 a 6 vezes maior que aqueles formados há mais tempo, e nos primeiros, a frequência de cópulas não parece diretamente relacionada ao perfil hormonal da fêmea.[20][68]
As fêmeas estão aptas a se reproduzir com 15-20 meses de idade, mas só vão efetivamente ter filhotes com trinta meses, e os machos alcançam a puberdade com 28 meses de idade.[20][67] Apenas a fêmea dominante se reproduz, inibindo o estro das outras fêmeas: em geral, as fêmeas jovens ainda residentes em seus grupos familiares de origem não apresentam o ciclo estral.[69] Os micos-leões possuem um estro pós-parto, estratégia que evoluiu como forma de permitir que as fêmeas tenham duas ninhadas consecutivas na estação mais chuvosa do ano, de forma a maximizar a sobrevivência da prole.[70]
Os machos perdem peso durante o período de estro da fêmea, o que demonstra que a competição por cópulas é uma atividade desgastante, assim como o cuidado com a prole.[70] Durante o período de estro da fêmea, as concentrações plasmáticas de hormônios andrógenos, como a testosterona, são maiores nos machos dominantes, como previsto pela hipótese do desafio.[58] Existe competição por cópulas, e o macho dominante é responsável pela maior parte das cópulas em grupos poliândricos, apesar de que em alguns grupos, todos copulam com a fêmea reprodutora.[56] Parece mais vantajoso para machos subalternos esperarem a morte do dominante do grupo ou de algum grupo próximo e ajudar no cuidado da prole do dominante, do que sair à procura de bandos longe para subir hierarquicamente.[56] Isso mostra que a estabilidade de grupos com dois machos não necessariamente é devido à incerteza de paternidade por conta do macho subalterno.[56] A cópula é feita como em muitos outros primatas, com o macho montando a fêmea (que se mantém em pé, apoiada nos quatro membros), segurando no quadril e apoiando as patas posteriores em algum galho ou outra superfície.[14]
Geralmente, dão à luz a gêmeos, sendo mais raros trigêmeos e filhotes únicos.[71] Possuem uma sazonalidade na reprodução, com a maior parte dos nascimentos ocorrendo entre os meses de agosto e fevereiro em animais residentes no hemisfério sul.[20] Em cativeiro, em animais residentes no hemisfério norte, os nascimentos ocorrem entre janeiro e junho.[20] Os filhotes de micos-leões nascem com um peso de 60 g em média, mas esse valor pode variar.[14] Indivíduos nascidos em cativeiro tendem a ser mais pesados que aqueles nascidos em liberdade.[70] Filhotes nascidos na estação mais seca do ano também tendem a ter um peso menor. A taxa de mortalidade de filhotes de mico-leão é alta, tanto em cativeiro, quanto em liberdade.[70]
Todos no bando ajudam no cuidado com a prole, porém, a maior parte do cuidado é feito por indivíduos adultos, e em cativeiro, observa-se que há uma predominância no cuidado feito por machos.[72] O filhote é carregado pela mãe até a terceira semana, e a partir dai ele passa a ser quase que exclusivamente carregado pelo macho, sendo que a fêmea só o carrega para amamentá-lo.[38][72] Apesar de todos os machos em grupos poliândricos ajudarem, ela provavelmente é apenas do dominante.[7][56] Eventualmente, o filhote não é de nenhum dos machos do bando, o que mostra que existe uma certa porcentagem de cópula extra grupo, e já ocorreu de não ser também da fêmea, evidenciando que existe adoção nesses animais, mesmo em estado selvagem.[7]
Durante o tempo que o macho cuida da prole, as concentrações plasmáticas de andrógenos diminuem, ao contrário do que é observado no período de acasalamento.[58] Ademais, a ajuda de outros indivíduos do bando (chamados helpers) parece preponderante na sobrevivência dos filhotes, visto que bandos em que possuem mais de um macho (ou seja, mais de um helper) apresentam mais filhotes do que bandos com um macho somente.[56] A ajuda do macho parece importante também na sobrevivência da prole, e não foi observado fêmeas cuidando de filhotes sem machos.[57] Essa parece ser uma das razões pela qual a poliginia nos mico-leões é rara, já que se existem muitas fêmeas reprodutivas no bando, o potencial de ajuda paterna diminui com cuidados e recursos do macho sendo divididos com várias fêmeas.[57] Isso fica evidente com o fato de que bandos poliândricos têm mais filhotes do que os poligínicos.[57] O juvenil vai ficando independente aos poucos, e a partir da 12ª semana, ele quase não é mais carregado pelos adultos do bando.[72]
O mico-leão-dourado é listado como uma espécie em perigo, tanto pela União Internacional para a Conservação da Natureza e dos Recursos Naturais (IUCN) quanto pelo Instituto Chico Mendes de Conservação da Biodiversidade (ICMBio).[3][73] Atualmente, sua distribuição geográfica é muito restrita (ela se restringe a uma área de 154 km²[15]) mas graças aos esforços para a sua reprodução e reintrodução, existem cerca de 3200 mico-leões na natureza,[74] sendo que a maior população é encontrada na Reserva Biológica Poço das Antas e em fragmentos nos arredores na bacia do rio São João, que juntos, somam cerca de 500 animais.[17][18] Na Reserva Biológica União, a população é de pouco mais de 120 indivíduos reintroduzidos, porém, a capacidade de suporte nesta unidade de conservação é de 158 indivíduos, o que mostra que logo ela não pode abrigar mais indivíduos.[15] O desmatamento para retirada de madeira, agricultura e pecuária, e a caça para o comércio ilegal de animais silvestres, contribuíram para uma redução drástica das populações do mico-leão-dourado, principalmente na década de 1960.[18] A paisagem em que habita o mico-leão-dourado atualmente está altamente fragmentada, obrigando as populações remanescentes a viverem em remanescentes isolados e reduzidos, com poucos excedendo 1000 ha, o que dificulta muito as ações conservacionistas.[75] A conservação também é dificultada visto existirem espécies invasoras em seu habitat, como o sagui-de-tufos-brancos e o mico-estrela.[76] Recentemente, em 2002, também foi reportada a introdução do mico-leão-de-cara-dourada, próximo a Niterói, e em 2009 ela tinha resultado em cerca de 107 animais ocorrendo a menos de 50 km da área de ocorrência do mico-leão-dourado.[77] A presença dessa outra espécie de mico-leão é uma ameaça adicional ao mico-leão-dourado, visto que pode ocorrer competição e a hibridização entre elas, descaracterizando geneticamente as populações.[77]
A taxa de sobrevivência dos animais reintroduzidos tem sido encorajadora, mas a destruição de habitat desprotegido continua.[45] A maior parte dos fragmentos de floresta estão em propriedades particulares, e a criação de reservas particulares faz parte da estratégia de se conseguir 25 000 hectares de florestas protegidas para o mico-leão-dourado.[78] A intensa fragmentação do habitat dificulta o contato entre populações e o estabelecimento de novas, e trabalhos de reflorestamento, principalmente ligando fragmentos são preponderantes para minimizar esses efeitos.[78] Na bacia do rio São João, foi criada uma área de conservação de uso sustentável em 2002, a Área de Proteção Ambiental da Bacia do rio São João/Mico-leão-dourado, com 150 700 hectares.[78] Esta área visa normatizar o uso da terra na área de distribuição do mico-leão-dourado, minimizando a perda de habitat.[78] Entretanto, deve-se salientar que apenas a Reserva Biológica Poço das Antas e a Reserva Biológica União contribuem significativamente para a meta de 25 000 hectares de florestas protegidas.[78] Enquanto os corredores ecológicos não são devidamente implantados, a translocação de micos-leões entre os fragmentos de floresta tem se mostrado eficiente no repovoamento de áreas em que mico-leão-dourado foi extinto.[79]
A educação ambiental e a formação de uma consciência ecológica coletiva é outra importante estratégia na conservação da espécie, pois acaba culminando na colaboração da própria população local.[80] Esta colaboração mostrou-se crucial.[80] Organizações Não-Governamentais, como o SOS Mata Atlântica e a Associação Mico-Leão-Dourado, iniciaram um trabalho na popularização da espécie, e na sua relação com a Mata Atlântica, veiculando informações principalmente por redes de televisão e rádio, fazendo com que a necessidade de preservação do mico-leão-dourado ultrapassasse os limites regionais.[80] A criação de uma mentalidade diferente na gestão da terra, também foi importante, fazendo que um modo de produção agroflorestal seja implementado em alguns assentamentos de reforma agrária, que acaba sendo uma forma mais sustentável de agricultura e mais integrada à conservação dos remanescentes de floresta e do mico-leão-dourado.[80]
Em 1969 descobriu-se que o número de indivíduos na Mata Atlântica era menos de 150.[81] Foi entre 1965 e 1970, que foi registrado o maior declínio nas populações do mico-leão-dourado.[5] Graças ao trabalho de Adelmar Coimbra-Filho, na década de 1970 a comunidade científica passou a se interessar pela conservação dessa espécie, culminando na criação da Reserva Biológica Poço das Antas e em um programa bem sucedido de reprodução em cativeiro.[82] Antes dessa mesma década, Coimbra-Filho lutou pela preservação de uma área de 400 km² em Poço D'Anta, ao redor do rio Iguape, para manter uma população viável de mico-leões, entretanto, tal unidade de conservação não se concretizou e a região foi desmatada.[5] Em 1975 a espécie foi listada no Appendix I da CITES, categoria dada aos animais ameaçados de extinção que podem ser ou estão sendo afetados pelo tráfico.[83] A espécie foi listada como "em perigo" pela IUCN em 1982,[3] e em 1984 o Smithsonian National Zoological Park e a World Wide Fund for Nature, através da Associação Mico-Leão-Dourado, começaram um programa de reintrodução em 140 zoológicos.[81] Apesar do sucesso do programa, a classificação da IUCN subiu para "em perigo crítico" em 1996.[3] No ano 2000, na primeira lista dos "25 primatas mais ameaçados do mundo", o mico-leão-dourado esteve presente, mas nas publicações seguintes não esteve mais, visto os grandes esforços feitos em sua preservação.[84] Em 2003 o estabelecimento bem sucedido de uma nova população na Reserva Biológica União permitiu rebaixar a espécie para "em perigo",[85] mas com uma advertência de que a extrema fragmentação do habitat pelo desmatamento faz com que a população selvagem tenha pouco potencial para uma expansão territorial adicional.[3][18] Muitas outras reintroduções tiveram sucesso e aos poucos as populações remanescentes estão sendo conectadas entre si.[82] Apesar de novos problemas surgirem (como a ocorrência de espécies exóticas de primatas em seu habitat), não há dúvidas de que, após seu início 30 anos antes, a conservação do mico-leão-dourado é atualmente um sucesso, e é provável que até 2025 ele já esteja livre da ameaça iminente de extinção.[82][86] O recente censo que mostrou existirem 3200 micos-leões em liberdade dá esperanças para tal, dado que essa população parece suficiente para manter a espécie viva.[74]
As populações em cativeiro do mico-leão-dourado têm sido gerenciadas globalmente desde 1973.[87] Nos anos 80, a população chegou a 550 indivíduos, mas após várias reintroduções, em 2001, ela era de 489 indivíduos, distribuídos em 143 zoológicos em 29 países e se mantém estável atualmente.[87] O nível de endogamia é adequado, mas a diversidade genética de animais em cativeiro não é alta.[87]
O programa de reintrodução dos animais teve seu início em 1984, e dos cerca de 1000 indivíduos na natureza, atualmente, 360 são de animais reintroduzidos.[87] A reintrodução foi feita com sucesso em 21 fazendas na bacia do rio São João.[15] A alta fragmentação do habitat dificulta o retorno de animais à natureza e a translocação, assim como a predação é fonte de perda de muitos animais reintroduzidos.[45][87]
O manejo de animais nascidos em cativeiro e reintroduzidos é feito usando o conceito de "metapopulação".[87] Animais são translocados entre os fragmentos de floresta e entre zoológicos no mundo inteiro, o que faz com que as populações não estejam inteiramente isoladas, permitindo variabilidade genética necessária para a viabilidade das populações de mico-leão-dourado a longo prazo.[87]
O mico-leão-dourado é um animal carismático e já foi desejado como animal de estimação, o que por muito tempo foi um grande problema na conservação da espécie, por ser altamente visado no tráfico ilegal de animais silvestres: Adelmar Coimbra-Filho relata que uma única pessoa coletou 300 indivíduos em apenas cinco anos na década de 1960.[88] Sua primeira referência pelos europeus foi em 1519, quando o padre Antonio Pigafetta o descreveu como "lindos gatos próximos a micos e similares a leões".[5] Sua forma peculiar e pelagem vistosa o tornou popular entre os aristocratas no século XVI e século XVII, sendo bastante retratado em pinturas nessa época.[5]
Atualmente, se tornou um símbolo de conservação de toda a Mata Atlântica e da preservação do meio ambiente em geral, tanto no Brasil quanto no mundo.[80] É uma das principais "espécies bandeira" na conservação desse bioma altamente fragmentado, junto com o muriqui.[88] Por vezes, acaba sendo um símbolo do Brasil propriamente dito (é representado, inclusive, na cédula de vinte reais),[89] e foi candidato a mascote da Copa do Mundo de 2014.[90]
O mico-leão-dourado (nome científico: Leontopithecus rosalia) é um primata endêmico do Brasil, da família Callitrichidae e gênero Leontopithecus. Ocorre exclusivamente na Mata Atlântica brasileira, no estado do Rio de Janeiro, mas alguns autores já consideraram sua ocorrência no sul do Espírito Santo. Atualmente, são encontrados principalmente na Reserva Biológica Poço das Antas e na Reserva Biológica União, e vivem nos estratos mais altos da floresta. Podem ser encontrados em trechos de floresta secundária. Já foi considerado como uma subespécie, hoje é uma espécie propriamente dita, como as outras espécies de micos-leões. Evidências de estudos filogenéticos mostram que o mico-leão-preto é a espécie mais próxima do mico-leão-dourado. Não existem fósseis conhecidos da espécie.
Junto com outros micos-leões é o maior membro da subfamília Callitrichinae, podendo pesar até 800g. A pelagem varia do dourado ao alaranjado com uma juba muito característica, que lhe conferiu o nome popular. Apresenta garras em vez de unhas e o terceiro dedo da mão é muito longo e usado para procurar presas. O dimorfismo sexual não é acentuado. O crânio é pequeno e menos robusto, se comparado com outros micos-leões. Possui 30 dentes, sendo os incisivos muito semelhante a caninos.
São animais diurnos e muito ativos durante as primeiras horas da manhã. Os comportamentos sociais são muito semelhantes a de outros primatas. Vivem em grupos de até 9 indivíduos, organizados em grupos familiares, sendo comum a poliandria. A poliginia pode ocorrer em menor proporção. Os territórios variam em tamanho, podendo ter até 217 hectares de área. A fragmentação do habitat fez com que muitos territórios se sobreponham sobre de outros. São animais onívoros, se alimentando de frutos, invertebrados e pequenos vertebrados na estação chuvosa e de néctar na estação seca. Tem um repertório variado de vocalizações, que são emitidas em contextos específicos. Dão à luz a gêmeos, depois de uma gestação de 130 dias. Os machos ajudam com o cuidado na prole, assim como crias de anos anteriores.
É uma espécie que corre risco de extinção, listada como espécie em perigo tanto pela IUCN quanto pelo ICMBio. Ocorre quase que exclusivamente na Reserva Biológica Poço das Antas, na Reserva Biológica União e em fragmentos florestais nos arredores, na bacia do rio São João, no estado do Rio de Janeiro. Existem cerca de 3 200 indivíduos em liberdade, graças a inúmeros esforços na conservação e reprodução da espécie. As populações em cativeiro são relativamente numerosas e estáveis. O mico-leão-dourado é uma espécie bandeira na conservação da Mata Atlântica brasileira.
 Stare de conservare
Stare de conservare
 Modifică date / text
Modifică date / text Maimuța leu roșcată, numită și tamarin leu ('Leontopithecus rosalia') este o maimuță întâlnită în special în sud-estul Braziliei.
Această specie este sensibilă la expunerea directă la razele de soare, în zilele de caniculă se adăpostește la umbra frunzelor mari.
Personalitate: Tamarinul de aur este o maimuță sociabilă, trăiește în grupuri bine ierarhizate (8-10 membrii). Comunică prin țipete, emit un sunet specific pentru a-i anunța pe ceilalți membrii atunci când găsesc ceva de mâncare.Maimuța leu își desfășoară activitatea pe timpul zilei, la înălțime, în coroana copacilor înalți din pădurea tropicală.Pe timpul nopții doarme.
Înmulțire: Femela poate să aibă pui după vârsta de 2 ani.Cel mai des,are pui doar femela dominantă din grup.Ceilalți membrii o ajută în creșterea puilor.Maimuța leu roșcată se împerechează, de obicei, într-o singură perioadă a anului.Puii se nasc între lunile septembrie și ianuarie.Femela naște 1 sau 2 pui,și în unele cazuri 3 pui.Gestația durează aproximativ 130 de zile.
Alimentație: Această maimuță se hrănește în mod special cu fructe tropicale și flori, în unele cazuri vânează reptile,se hrănesc și cu ouă și insecte.
Speranța de viață: Maimuța leu trăiește în medie 11 ani, în captivitate speranța de viață este mai pozitivă, ele pot ajunge la 15 ani.
Aspect și dimensiuni: Maimuța leu are părul lung, catifelat și strălucitor.Coama din jurul gâtului o aseamănă cu leul, și datorită ei maimuța a primit numele.Corpul său atletic îi oferă multă mobilitate, și se poate deplasa cu ușurință de la un copac la altul.Dimensiuni: capul și trunchiul au 20-34 cm, coada 32-40 cm.Greutatea este cuprinsă între 700 g și 1 kg.
Maimuța leu roșcată, numită și tamarin leu ('Leontopithecus rosalia') este o maimuță întâlnită în special în sud-estul Braziliei.
Această specie este sensibilă la expunerea directă la razele de soare, în zilele de caniculă se adăpostește la umbra frunzelor mari.
Personalitate: Tamarinul de aur este o maimuță sociabilă, trăiește în grupuri bine ierarhizate (8-10 membrii). Comunică prin țipete, emit un sunet specific pentru a-i anunța pe ceilalți membrii atunci când găsesc ceva de mâncare.Maimuța leu își desfășoară activitatea pe timpul zilei, la înălțime, în coroana copacilor înalți din pădurea tropicală.Pe timpul nopții doarme.
Înmulțire: Femela poate să aibă pui după vârsta de 2 ani.Cel mai des,are pui doar femela dominantă din grup.Ceilalți membrii o ajută în creșterea puilor.Maimuța leu roșcată se împerechează, de obicei, într-o singură perioadă a anului.Puii se nasc între lunile septembrie și ianuarie.Femela naște 1 sau 2 pui,și în unele cazuri 3 pui.Gestația durează aproximativ 130 de zile.
Alimentație: Această maimuță se hrănește în mod special cu fructe tropicale și flori, în unele cazuri vânează reptile,se hrănesc și cu ouă și insecte.
Speranța de viață: Maimuța leu trăiește în medie 11 ani, în captivitate speranța de viață este mai pozitivă, ele pot ajunge la 15 ani.
Aspect și dimensiuni: Maimuța leu are părul lung, catifelat și strălucitor.Coama din jurul gâtului o aseamănă cu leul, și datorită ei maimuța a primit numele.Corpul său atletic îi oferă multă mobilitate, și se poate deplasa cu ușurință de la un copac la altul.Dimensiuni: capul și trunchiul au 20-34 cm, coada 32-40 cm.Greutatea este cuprinsă între 700 g și 1 kg.
Vanliga lejontamarinen, Vanliga lejonapan, röda lejonapan eller bara lejonapan (Leontopithecus rosalia), är en starkt utrotningshotad lejontamarin i familjen kloapor (Callitrichidae). Namnet har den fått av sin gyllene man runt ansiktet.
Den vanliga lejontamarinen har en gyllene päls med en lång, bakåtsvept man som täcker öronen och inramar det mörka, nästan nakna ansiktet. Kroppslängden är 34-40 cm och svansen är 26-38 cm. Vikten varierar mellan 630 och 710 gram. [2]
De främre extremiteterna är något längre än bakbenen men inte lika tydlig som hos andra kloapor. Arten har händer som är kortare än bakfötterna med en tumme som inte är motsättlig. Honan har två spenar som ligger ungefär vid bukens centrum.[3]
Den vanlig lejontamarinen listas emellanåt som en separat art (Leonthopithecus rosalia)[4], men ibland anses den vara en underart av lejontamarinen (Leontopihecus rosalia rosalia)[5].
Den vanlig lejontamarinens förekomst begränsas till låglandskogar (under 300m ö.h.) vid kusten i staten Rio de Janeiro i Brasilien [6]. Den ursprungliga förekomsten omfattade de flesta av de låglänta kustområdena i delstaten Rio de Janeiro. Tidiga uppskattningar om populationens storlek på 1970-talet varierade allt från 200 till 600 individer.[7][8]
Mellan åren 1991 och 1992 utfördes en fullständig och grundlig inventering över beståndets storlek. Det totala antalet individer beräknades vara 562 (intervallet 470-631). Ca 290 av dem levde i det biologiska reservatet Poço d’ Anta, och resten av populationerna var belägna i kommunerna Silva Jardim, Cabo Frio, Saquarema och Araruama. Den totala arealen med lejonapor var 104,5 km ².[9]
I december 2000 var antalet individer 579. Lejonaporna i Poço d’ Anta hade minskats till 220 individer på grund av rovdjuren, men mängden djur utanför reservatet hade ökat med ca 90, främst genom den lyckade etableringen av lejonapor i det biologiska reservatet i União år 1994.[10]
Den aktuella uppskattningen av arten är över 1000 individer i naturen . Det finns få skogsområden som skulle kunna möjliggöra en ytterligare expansion av beståndet. Ifall arten skulle använda sig av hela den tillgängliga livsmiljön, skulle antalet vara vid ca 2000. Därför är det viktigt att se till att skogarna inte huggs ned om den fortsatta överlevnaden av denna art skulle vara möjlig.[11]
Populationstätheter
Populationsutveckling: Stabil
Den vanlig lejontamarinen lever som sagt i låglandsskogarna vid Atlanten med en årsnederbörd på 1500 mm per år [14]. Enligt forskningar kan de även klara sig i torrare skogar, ifall deras krav på föda och boplatser förverkligas[15].
Lejonapor äter både frukter, blommor, nektar och grodor, sniglar, ödlor, spindlar och insekter [16]. De lever i familjegrupper av vanligtvis 4 till 8 medlemmar (Medeltal:5,8 intervall:3-11) i Poco d’ Anta [17]. Arten har en dräktighetstid på 128 dygn, och honan föder tvillingar en gång i året [16]. Familjegrupperna lever på revir på 45 hektar (intervall 21-73) i Poco d’Anta [18] och på 150 hektar (intervall 65-229) i Uniãno[13].
Nyfödda ungar är vanligen 10 till 11cm långa (huvud och bål) med en 12 till 14 cm lång svans och en vikt av 52 till 74,5 g. De har redan päls och öppna ögon. Ungarna klamrar sig sedan fast i moderns päls under två till tre veckor. Sedan lämnar de modern tillfällig och efter cirka 8 veckor har de full rörelseförmåga. Efter ungefär 12 veckor slutar honan med digivning och ungarna börjar efter 32 till 40 veckor med markeringar av reviret. Könsmognaden infaller uppskattningsvis efter 18 månader. Vanliga lejontamariner i fångenskap levde 10 till 15 år.[3]
Lejonapan lever i de områden som koloniserades först i Brasilien på 1600-talet. Idag är regionen fortfarande det mest tätbefolkade i hela landet och centrum för landets jordbruk och industri[16].
På 1960-talet exporterades hundratals djur utomlands lagligt som sällskapsdjur. Den illegala handeln fortsatte också efter att man vidtagit internationella skyddsåtgärder. Samtidigt röjde man låglandsskogarna till åkrar och betesmarker, och artens livsmiljö har blivit mindre och mindre[16].
Vanliga lejontamarinen, Vanliga lejonapan, röda lejonapan eller bara lejonapan (Leontopithecus rosalia), är en starkt utrotningshotad lejontamarin i familjen kloapor (Callitrichidae). Namnet har den fått av sin gyllene man runt ansiktet.
Leontopithecus rosalia là một loài động vật có vú trong họ Cebidae, bộ Linh trưởng. Loài này được Linnaeus mô tả năm 1766.[2] Đây là loài bản địa rừng ven biển Đại Tây Dương của Brasil, loài này là loài nguy cấp với số lượng khoảng 1500 con và trải ra trong ba địa điểm dọc theo đông nam Brasil, và số lượng nuôi nhốt khoảng 490 con trong 150 sở thú.[1][3]
Leontopithecus rosalia là một loài động vật có vú trong họ Cebidae, bộ Linh trưởng. Loài này được Linnaeus mô tả năm 1766. Đây là loài bản địa rừng ven biển Đại Tây Dương của Brasil, loài này là loài nguy cấp với số lượng khoảng 1500 con và trải ra trong ba địa điểm dọc theo đông nam Brasil, và số lượng nuôi nhốt khoảng 490 con trong 150 sở thú.
Золотистая львиная игрунка[1], или золотистый львиный тамарин[2], или золотистая игрунка[2], или розалия[2] (лат. Leontopithecus rosalia) — обезьяна из семейства Игрунковых.
В природе осталось всего 3500 особей и еще около 490 держатся в 150 зоопарках. Их численность продолжает снижаться. Технический прогресс на атлантическом побережье Южной Америки сильно сократил их ареал. Незаконная добыча минералов и вырубка, незаконная ловля и продажа как домашних зверей особенно сильно сократили популяцию золотистых львиных тамаринов. Также из-за снижения популяции стали частыми родственные скрещивания животных, которые сильно влияли на их жизнедеятельность. До 1996 г. они были на грани исчезновения, но успешная реализация проекта реинтродукции позволила данному виду несколько восстановить численность.
Поскольку вероятность полного исчезновения золотистых игрунок из природы очень высока, была принята программа по их спасению. Все живущие в неволе особи внесены в особый каталог, так называемую племенную книгу. В ней отмечены все этапы жизни каждой особи, указывается их родословная для того чтобы не позволить близкородственные скрещивания. Правительство Бразилии взяло полную ответственность за сохранение этого исчезающего вида. Все тамарины, живущие в неволе, являются собственностью Бразилии.
Среди местного населения тамарин очень уважается. Считается что встреча этого редкого животного понесет счастливые последствия.
Львиный тамарин обитает в Южной Америке, около местности Риу Сан Жуан, около городов Риу дас Острас, Рио Бонита и Казимиро де Абреу. Тамарины активны на протяжении от рассвета до заката. Они создают себе место для ночлега перед сумерками и каждый день это место меняют. Ранним утром они завтракают найденными плодами фруктовых деревьев, а потом переключаются на полную протеина трапезу из насекомых. После того предусмотрительно выбирают себе будущий ночлег. Также надо отметить что они предпочитают спать группами в укромных местах: выемках старых дуплистых деревьев, расщелинах утёсов или зарослях густой лианы.
Их рацион достаточно богат. Они едят множество спелых фруктов, разнообразных насекомых, не брезгуют ящерицами, яйцами птиц и также не прочь полакомиться густой смолой определённых деревьев.
У них есть не только внешнее сходство со львом, но и сходство в поведении. Они живут группами, похожими на прайды львов. Есть один доминантный самец и одна или несколько половозрелых самок, а в сумме около 5-8 особей. Различие лишь в том что в группе могут присутствовать и самцы, но при этом только один из них будет доминантным и иметь право на спаривание. Так же как и львы тамарины очень территориальные животные. Они пристально следят за соседствующими группами и не делятся своей территорией ни с кем.
Брачный период начинается в апреле, а потомство появляется в промежутке между сентябрём и февралём. Чаще всего появляется 2 малыша. Над их опекой трудится их отец. Первые 2 месяца жизни он возит их у себя на спине, где они вцепляются ему в шерсть своими пальцами. Он отдаёт их матери только на время кормления, а потом опять их забирает.
Половозрелыми детёныши золотистого львиного тамарина становятся в возрасте 2-х лет.
Золотистый львиный тамарин — небольшая обезьянка, достигает 900 грамм веса, это самый крупный представитель игрунок (длина тела около 20-25 см). Название получил из-за очевидного сходства со львом. Рядом с головой он имеет что-то наподобие гривы, пышную золотистую (очень похожую по блеску на этот металл) шерсть, особенно выразительную в области головы. Столь насыщенный ярко-рыжий цвет в шерсти обусловлен высоким содержанием каротина в пище этого зверька. Эта особенность напоминает особенность птицы фламинго, для которой характерен розовый цвет перьев из-за большого употребления ракообразных.
Тамарин имеет крупные карие глаза, заметные ноздри в виде дырочек над ртом и рот который распластался на протяжении всего лица. Само лицо цветом варьируется от фиолетово-телесного до светло-коричневого. Лицо почти без шерсти. Есть только немного шерсти на лбу и на подбородке. Немного напоминает лицо кошки. Также нету шерсти на пятипалых ладонях и на ступнях.
Имеет длинный (около 32-37 см) хвост, с приглаженной шерстью, которая значительно короче шерсти у головы. По строению напоминает кошачий.
Золотистая львиная игрунка, или золотистый львиный тамарин, или золотистая игрунка, или розалия (лат. Leontopithecus rosalia) — обезьяна из семейства Игрунковых.
В природе осталось всего 3500 особей и еще около 490 держатся в 150 зоопарках. Их численность продолжает снижаться. Технический прогресс на атлантическом побережье Южной Америки сильно сократил их ареал. Незаконная добыча минералов и вырубка, незаконная ловля и продажа как домашних зверей особенно сильно сократили популяцию золотистых львиных тамаринов. Также из-за снижения популяции стали частыми родственные скрещивания животных, которые сильно влияли на их жизнедеятельность. До 1996 г. они были на грани исчезновения, но успешная реализация проекта реинтродукции позволила данному виду несколько восстановить численность.
Поскольку вероятность полного исчезновения золотистых игрунок из природы очень высока, была принята программа по их спасению. Все живущие в неволе особи внесены в особый каталог, так называемую племенную книгу. В ней отмечены все этапы жизни каждой особи, указывается их родословная для того чтобы не позволить близкородственные скрещивания. Правительство Бразилии взяло полную ответственность за сохранение этого исчезающего вида. Все тамарины, живущие в неволе, являются собственностью Бразилии.
Среди местного населения тамарин очень уважается. Считается что встреча этого редкого животного понесет счастливые последствия.
金獅面狨(學名:Leontopithecus rosalia)也叫金狨,是卷尾猴科的一種新世界猴。原產于巴西的大西洋沿岸地區。為瀕危物种,野生金獅面狨大約有1000隻分布在巴西东南部的三个地区,圈養數量约為490隻,分散在150个动物园。[2][1]
金狮面狨名字来自亮红橙色毛发,脸和耳朵周围超长毛发,使其显得与众不同的鬃毛[3]。金狮面狨面部是黑色的和无毛的。普遍认为,金狮面狨的毛色来自阳光和食物中的類胡蘿蔔素。[4] 金狮面狨是狨亚科中的最大的物种,通常长约26厘米,重约620克,雌雄在体型上几乎没有差别。如所有新世界猴一样,金狮面狨也有锋利的爪子,不像包括人类在内的灵长目动物一样长着平指甲。[5] 锋利的爪子使金狮面狨抓住树干,也使它能够四足沿树枝行走、奔跑和跳跃。[6] 因此,金狮面狨移动不像灵长目动物,更像松鼠。
金狮面狨分布范围很有限,随着时间推移,巴西原金狮面狨栖息地只剩下2–5%。[7] 今天,金狮面狨栖息地限于巴西东南部热带雨林里三个小的区域:波蘇達斯安塔斯生物保护区(英语:Poço das Antas Biological Reserve)、法曾达联合生物保护区和私人放生地[2]。1972年估算金狮面狨数量为400至500之间,到1981年,数量降至低于200,1995年调查结果为,野外金狮面狨数量至多仅有400。金狮面狨生活在巴西东南边境的席尔瓦雅尔丁、卡波弗里奥、萨夸雷马和 阿拉鲁阿马等市。[8] 金狮面狨已经被成功引入到 里约达斯奥斯特拉斯、里约博尼图和 卡西米鲁迪阿布雷乌等市[9]。 金狮面狨生活在海拔300米以下的沿海低地雨林[10]。金狮面狨在山林和沼泽林里也有分布。
金狮面狨每天活跃时间最多12小时,每天在不同的洞穴里睡觉。[11][12]金狮面狨经常迁徙巢穴,群居生活,尽可能减少留下的气味,减少被猛兽发现的几率。[13]金狮面狨白天的首要活动是游荡和觅食水果,到傍晚回归巢穴。金狮面狨以树洞、藤蔓或附生植物等处为穴。巢穴距离地面11、15米(36、49英尺)。气温越高降雨越多的季节,由于白天较长,金狮面狨的活动时间也相应变长,回穴时间相应变晚。[11] 在旱季,金狮面狨会花较长时间觅食昆虫。[11][12]
金狮面狨的突出特征是在树皮下觅食和以附生植物凤梨为食。觅食地点通常分布在它们的巢穴范围周围,面积很大,平均为123英亩,这样才能长期有充足的食物,即便不同群体的觅食点有交叠,冲突也比较小(50%的时间里在11%以内巢穴范围内活动)。[14]
金狮面狨是杂食动物,几乎无所不吃,比如水果、鲜花、花蜜、鸟卵、昆虫和小型脊椎动物。[11][12]金狮面狨会用爪子灵巧地从裂缝、树叶、密丛中获取食物, [15] 昆虫占金狮面狨食物的10–15%,其余食物大部分是水果。在雨季,金狮面狨主要吃水果,在旱季,主要吃其他食物,如花蜜和树胶。[11] 昆虫不够吃的时候,金狮面狨也抓小型脊椎动物吃。
金狮面狨是群居动物,成员2-8只,一般包括1只成年雄性和雌雄,但也可以包括1只雌性和2-3只雄性或1只雄性和2-3只雌性。[16]其他成员包括两种性别的亚成年、未成年和幼年金狮面狨, 这些成员一般是成年金狮面狨的后代。如果有不止一只成年成员,通常有一只成年成员处于支配地位,这一地位是通过争斗维持的。支配关系与在群体中生活时间长短有关,新加入的雄性面狨受群体中成年雌性面狨支配,雌性面狨的地位从其母亲继承而来。[17] 雄性和雌性面狨在4岁的时候可以离开群体,但是雌性面狨在她们的母亲死后,可能取代其母亲,负责哺育后代,这也会使育龄雄性面狨离开,很可能是他们的父亲。这种情况不会发生在面狨父子之间。离开的雄性面狨会加入其他雄性面狨的群体,直到有机会迁移到新的群体。群体绝大多数新加入的成员为雄性。[18] 一只雄性面狨可能找机会会加入一个雄性面狨死去或失踪的群体。雄性也可能会靠暴力赶走一个群体的雄性面狨,这常发生在兄弟之间。当这种情况发生时,只有一种雄性面狨留下来负责繁育后代。群体中雄性面狨也可能在其女儿可以繁育后代时离开群体,这可以避免近亲繁殖。[19] 金狮面狨极其有领地意识,会与入侵的其他的群体斗争,保护领地边界和资源。[20]
金狮面狨叫声为"whine"和"peep" ,分别表示警告和联盟。[21] 金狮面狨觅食时或争斗时向天敌或同类发出"Clucks"叫声。[22] 金狮面狨远距离通信时发出"Trills"的声音,以确定个体的位置。金狮面狨玩耍时发出"Rasps" 或 "screeches"的叫声。金狮面狨释放化学物质明示领地范围,化学物质常由繁殖期面狨释放,非繁殖期面狨几乎不释放这样的化学物质。 群体中的雄性头领用气味标识自己在群体中的地位,可能会抑制其他雄性面狨的繁殖能力。
金狮面狨是一夫一妻制。群体中有两个成年雄性面狨时,只有一只可以与雌性性交。有时候一只雄性可以与两只雌性性交,通常情况下,这两只雌性是母女。[16] 繁殖是季节性的,与降雨有关。性交高发期在雨季末,在三月末与六月中之间,生产高峰在9月至2月期间的雨季。[23] 雌性在15-20个月大时性成熟,但直到30个月大后才能繁殖。[22] 只有雌性头领才能繁殖后代,会阻止其他雌性繁殖后代。[24]雄性在28个月大时进入青春期。[23] 金狮面狨孕期历时4个月,群体集体养育后代。金狮面狨一般情况下一胎生两个,有时候一胎生三个或四个。母亲不能独自赡养幼仔,需要群体成员的帮助。[25] 群体里年轻成员可能会失去繁殖后代的机会,但他们在辅助抚养幼仔的时候获得育儿经验。[17] 幼仔出生后四周内,完全靠母亲养育和携带,五周大的时候,呆在母亲背上的时间减少,开始自行活动。17周时进入幼年期,开始与群体成员进行社交活动。14个月大时进入亚成年期,开始表现出成年行为。
金狮面狨与大西洋沿岸森林里96种植物互利共生,金狮面狨为植物散布种子,植物为金狮面狨提供食物。金狮面狨在领地内到处走动,把植物的种子散布在母体植物远处,这为种子发芽创造理想条件。种子的分布对森林更新、遗传变异和濒危植物的存活非常重要。[26]
研究表明,对金狮面狨的捕猎在增加,这使金狮面狨数量显著减小。[27]1992年调查发现,野生金狮面狨数量为562只,分属109个群体。到2003年,平均一个群体有3.6 to 5.7只个体,密度为每平方公里0.39到2.35个群体[28] 捕猎常发生在金狮面狨的睡觉的巢穴里。金狮面狨大部分巢穴(约63.6%)为树洞,捕猎者把巢穴弄大,以便攻击金狮面狨,有时候会包圆整个家庭。金狮面狨喜欢的巢穴是一棵大树旁边的活着的树上的树洞,并被植物盖住一小部分洞口。这些巢穴不仅是金狮面狨睡觉的地方,还为其提供保护,并方便觅食。绝大部分树洞巢穴低于地面,以方便出入。选活树的树洞,因为这样的树洞更干燥温暖,昆虫少,这样可以降低患传染病的几率。洞口有覆盖物,以便面狨及时发现捕猎者和天敌,周围有大树,这样可以很快逃跑。[27]由于面狨的栖息地在退化,支持整个群体的树变得越来越少,有些面狨转把巢穴设在竹子(17.5%)、藤丛(9.6%)、凤梨科植物(4.7%)等植物上,这使自己更容易被捕猎。金狮面狨会换巢穴,但不经常。它们更倾向于重复使用能提供保护的巢穴,这使猎人容易锁定目标。金狮面狨会用气味标志自己的巢穴,这样可以在猎人活动活跃的下午更快地返回巢穴。但是气味太浓也方便猎人搜寻目标。森林滥砍滥伐愈演愈烈,使金狮面狨的生活空间越来越少,也减少了猎人的搜寻范围。 [29]
金狮面狨面临的威胁包括非法采伐、偷猎、采矿、城市化和基础设施建设、物种入侵。1969年, 大西洋沿岸森林里金狮面狨的数量下降到仅150只。[30] 1975年,金狮面狨被列入瀕危野生動植物種國際貿易公約附录I,这个附录里的物种为面临灭绝危险,这些物种通常是禁止在国际间交易。[31]1982年,金狮面狨被国际自然保护联盟列为濒危物种。[1] 1984年, 美国国家动物园和世界自然基金会开始金狮面狨野化放归计划,全球有140家动物园参与这项计划。[30]尽管这一计划取得一定成功,金狮面狨在1996年依然被国际自然保护联盟列为極危物種。[1] 2003年,联合生物保护区已经成功野放一定数量的金狮面狨,减缓了这一物种濒危的步伐。[32] 但是,国际自然保护联盟警告,金狮面狨栖息地严重的碎片化会限制这一动物的数量的增长的潜力。[1]为抑制金狮面狨数量锐减的趋势,多个保护区建设计划已经开始实施,目的是增加金狮面狨的数量,保持动物园圈养的数量在安全水平。放归野外的金狮面狨的存活率令人鼓舞,但是栖息地的破坏依然在继续。
由于金狮面狨栖息地损失严重,野生面狨数量在1980年代初达到 濒危状况。从1983年起,科学家和生态环保人士付出巨大努力,把动物园出生的金狮面狨放归大自然。在巴西政府的帮助下,生态环保人士建立了波蘇達斯安塔斯生物保护区(英语:Poço das Antas Biological Reserve)和联合生物保护区,作为野放地点。野放的目标包括包括增加数量和遗传多样性,扩大已有栖息地范围,引起公众注意,开展相关教育项目。[33]
野放的第一步是让动物在动物园内自由活动,但是它们活动的地方会放上像冰箱一样的巢箱,里面有它们的食物。它们被放归到保护区后,还需要接受大量的放归后培训和医疗照顾。放归后的6–18月的时间里会收到监控,每个群体中有1-2只成员会装备上电波项圈,以便监控,所有放归的动物的身上会打上特殊的标记,以便辨认。[33]
为了使金狮面狨免于灭绝,一些金狮面狨被从小的孤立的不安全的栖息地转移出来,送到更大的保护更好的森林,即被迁徙到联合生物保护区和波蘇達斯安塔斯生物保护区。把金狮面狨迁移到联合生物保护区的行动开始于1991年。[34]金狮面狨被迁移到新的地方,会面临患原来栖息地所没有的新疾病的风险。许多金狮面狨接触和患上了狨亚科肝炎。[35]
尽管面临疾病的挑战,联合保护区内被迁移的金狮面狨的数量从42只增加到200多只。巴西所有保护区和牧场里的金狮面狨的数量已经达到千只以上。1991年金狮面狨的数量曾低至200余只。到2025年,保护区内金狮面狨的数量预计会突破2000只。[34]
金狮面狨是原产于巴西大西洋沿岸森林里的动物。它们最初的栖息地从里约热内卢州南部到圣埃斯皮里图州南部。但是随着森林滥砍滥伐、捕猎、动物贸易等情形的加剧,金狮面狨现在只在里约热内卢的五个市有分布,绝大部分生活在波蘇達斯安塔斯生物保护区。[28]
森林被分成几千片,每片森林面积只有整个森林面积的8%。[36] 这直接影响了金狮面狨觅食的范围,减少了它们能够获取的资源的数量。[14]金狮面狨的领地范围也缩小了。[14]
金狮面狨栖息地对其习性和社交行为也有影响,比如树的种类对幼小面狨的习性和社交行为就有显著影响。幼小面狨与各种年龄和种类的面狨的社交玩耍对它们的社交技能、认知和动作技巧的发展具有关键作用,还会影响它们面对竞争和捕猎者的方式,它们的玩耍就是对应对竞争和捕猎者的预演。社交玩耍常在大的树枝(>10cm)上和藤蔓丛(距离地面4米高)中进行,这些地方比较安全。但是森林滥砍滥伐影响了森林的多样性,减少了玩耍的安全区域。因此,幼小面狨的玩耍活动减少,进而影响了它们对逃生技能的习得。另外,如果在危险区域玩耍,它们面临捕猎者的危险,造成面狨数量减少。这也威胁成年面狨的生存,因为成年面狨会把幼年面狨围在中间以保护它们。[37]
森林滥砍滥伐和碎片化还增大了近亲繁殖的概率,因此造成近交衰退和数量下降。[38] 近亲繁殖降低了遗传多样性的水平和存活率,近亲繁殖的后代的存活率低于非近亲繁殖的后代存活率。森林碎片化还降低了个体离群而走的可能性,结果造成与其他群体个体繁殖后代的可能性。[39] 生育推迟和领地的减少和短缺会给离群的金狮面狨寻找充足资源和领地带来很大压力,这样脱离群体就变得非常有风险和耗费精力,无力再繁殖后代。[40]
|archive-date=中的日期值 (帮助) |archive-date=中的日期值 (帮助) |archive-date=中的日期值 (帮助) |archive-date=中的日期值 (帮助) 金獅面狨(學名:Leontopithecus rosalia)也叫金狨,是卷尾猴科的一種新世界猴。原產于巴西的大西洋沿岸地區。為瀕危物种,野生金獅面狨大約有1000隻分布在巴西东南部的三个地区,圈養數量约為490隻,分散在150个动物园。


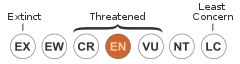 ワシントン条約附属書I 分類 界 : 動物界 Animalia 門 : 脊索動物門 Chordata 亜門 : 脊椎動物亜門 Vertebrata 綱 : 哺乳綱 Mammalia 目 : サル目 Primates 科 : オマキザル科 Cebidae 亜科 : マーモセット亜科 Callitrichinae 属 : ライオンタマリン属
ワシントン条約附属書I 分類 界 : 動物界 Animalia 門 : 脊索動物門 Chordata 亜門 : 脊椎動物亜門 Vertebrata 綱 : 哺乳綱 Mammalia 目 : サル目 Primates 科 : オマキザル科 Cebidae 亜科 : マーモセット亜科 Callitrichinae 属 : ライオンタマリン属ゴールデンライオンタマリン(Leontopithecus rosalia)は、哺乳綱サル目(霊長目)オマキザル科ライオンタマリン属に分類されるサル。
ブラジル(リオデジャネイロ州のサンジョアン盆地)[1][2][3] 固有種
体長25-31センチメートル[3]。尾長31.5-40センチメートル[3]。体重0.6-0.9キログラム[3]。マーモセット亜科最大種[1][3]。頭頂部や頬、頸部の体毛が鬣状に伸長し[1]、ライオンのように見えることが名前の由来[2][3]。全身の毛衣は光沢のある赤みがかった黄色で、名前の由来になっている[3]。種小名rosaliaは「バラの」の意[2]。
ライオンタマリン属の他種を本種の亜種とする説もある(その場合は和名がライオンタマリンとなり、基亜種がゴールデンライオンタマリンになる)[3]。
熱帯雨林に生息するが、開発に伴い熱帯雨林が減少したため二次林にも生息する[3]。昼行性で、夜間になると樹洞などで休み数年にわたり同じ樹洞を用いることもある[3]。200ヘクタールの行動圏内で生活する[3]。1頭のメスと主に2-3頭のオスが含まれる2-11頭の群れを形成して生活する[3]。
食性は雑食で、果実、花の蜜、樹脂、昆虫、陸棲の貝類、カエル、トカゲ、鳥類の卵などを食べる[1][3]。
繁殖形態は胎生。7-翌3月に1回に2頭の幼獣を年に2回に分けて産む[3]。寿命は15年以上[3]。
生息地では食用とされたこともあった[1]。
開発による生息地の破壊、ペットや展示用の乱獲などにより生息数は減少した[1][3]。ポソダンタ生物保護区の指定[1]、飼育下繁殖させた個体を再導入する試みが進められ生息数は増加している[3]。1960年代の生息数は200頭と推定されている[3]。
황금사자타마린 (Leontopithecus rosalia)는 비단원숭이과에 속하는 작은 신세계원숭이의 일종이다. 황금마모셋으로도 알려져 있다. 브라질의 대서양 해안 숲이 원 서식지이며, 황금사자타마린은 멸종위기종의 하나로 야생에서의 개체수가 약 1,000여 마리 이상 있는 것으로 추산되고 있다.[3]
z«dcASFaeGaer