en
names in breadcrumbs


Common names for Antilocapra americana include pronghorn, pronghorn antelope, and berrendo (Spanish). Antilocapra americana has also been known by the synonyms Antilope americanus, Antilope (Dicranocerus) furcifer, and Antilocapra anteflexa. There are currently five subspecies recognized: American pronghorns (A. a. americana Ord), Oregon pronghorns (A. a. oregona Bailey), Mexican pronghorns(A. a. mexicana Merrian), peninsula pronghorns (A. a. peninsularis Nelson), and Sonoran pronghorns (A. a. sonoriensis Goldman).
The fossil record dates to the Miocene. Antilocapra americana is the only extant species of a group that was once much more diverse, with 13 extinct genera of antilocaprines known from the Pliocene throughout the current range of A. americana.
Doe-fawn recognition seems to be through a combination of visual, vocal, and olfactory cues. Scent glands are widely used in male-male and male-female behavioral interactions. Scent glands are used to mark territories, attract potential mates, identify a mate, alert danger, or deter other males intruding in their territory. Both sexes have rump glands and interdigital glands; males also have a gland below each ear and on the back.
Communication Channels: visual ; acoustic ; chemical
Other Communication Modes: pheromones ; scent marks
Perception Channels: visual ; tactile ; acoustic ; chemical
It is estimated that up to 35 million pronghorns lived in North America before colonization by western Europeans. By 1924 this number had decreased to less than 20,000. Pronghorn populations have increased since that time and are now considered the second most numerous game species in North America.
The IUCN Red List lists Antilocapra americana as lower risk/least concern. Populations are stable, widespread, and relatively common throughout most of their range, with an estimated population size of 0.5 to 1 million. The U.S. Endangered Species Act recognizes two populations as endangered: Sonora pronghorns (A. a. sonoriensis) and peninsular pronghorns (A. a. peninsularis). Populations of Sonoran pronghorn in Mexico have been protected since 1967 and have undergone several recovery plans, the most recent in 1998. This population of pronghorn is listed under the Convention of International Trade of Endangered Flora and Fauna (CITES) Appendix I.
US Federal List: endangered
CITES: appendix i
State of Michigan List: no special status
IUCN Red List of Threatened Species: least concern
Pronghorns are grazers that will take advantage of wheat or alfalfa fields during the winter if there is deep snow. This may negatively impact crop yield. However, most pronghorn populations occur in areas with little agricultural development.
Negative Impacts: crop pest
Pronghorns are an important big games species in the western United States. Their use of open habitat means often hunters have success rates of up to 90 percent.
Positive Impacts: food ; body parts are source of valuable material; research and education
Throughout their range pronghorns co-occur with cattle, bison, sheep, and horses. Pronghorns can improve rangeland quality for these other speces by eating noxious weeds or invasive plants. Introduced livestock may overgraze areas they share with pronghorn, thus reducing cover and quantity of food. The reduction of cover may increase young mortality through predation.
Although there are few epizootic diseases that strongly affect pronghorn populations there are 33 species of roundworms, 21 genera of bacteria, 14 viral diseases, 8 species of protozoa, 5 species of tapeworms, 4 species of ticks, one fluke, and a louse fly that are known to infect them. "Bluetongue" disease has resulted in extensive mortality in some cases. It is an insect-borne viral disease (Bluetongue virus, BTV) that is transmitted by midges (Culicoides imicola). Worm infections have also resulted in extensive fawn mortality in some areas. Pronghorns that co-occur with sheep tend to have higher parasite loads than those in areas without sheep. Pronghorns are the definitive host of a nematode worm that also infects sheep and mule deer: Pseudostertagia bullosa (Nematoda: Trichostrongyloidea). They can also be parasitized by meningeal worms (Parelaphostrongylus tenuis) that are common parasites of white-tailed deer.
Mutualist Species:
Commensal/Parasitic Species:
Pronghorns are herbivores, eating stems, leaves, grasses and shrubs. Pronghorns have been described as "dainty" feeders, feeding on small amounts of a wide variety of plants. Particularly important in their is browse, especially sagebrush in winter. Pronghorns on grasslands have been observed starving in winter, whereas nearby populations in sagebrush survive well. Forbs with high water content are preferred in the summer diet and grasses are generally eaten only when there is new growth. Cacti are also eaten to some extent, especially in southern populations. Pronghorns use foregut fermentation with rumination to break down cellulose. Their stomach is enlarged and compartmentalized into four chambers, as in other ruminants. Water consumption varies with the water content of the vegetation available locally. When tender leaves are available, with moisture content of 75% or more, pronghorns do not seem to need to drink free-standing water. In dry seasons or areas, pronghorns are typically found within 5 to 6 km of water and may drink up to 3 liters per day.
Pronghorns must compete with introduced cattle (Bos taurus) and sheep (Ovis aries) throughout most of their range. In some areas, pronghorn are excluded from areas used by sheep, because the sheep eliminate much of their preferred vegetation. In other areas pronghorn and sheep seem to be able to coexist well. However, pronghorns can do well on areas overgrazed by cattle because they prefer forbs and browse. It is estimated that 1 cow can eat as much as 38 pronghorns. Fences constructed to enclose cattle and sheep can prevent pronghorn movement across rangeland, resulting in starvation and dehydration. Pronghorns can be considered a valuable part of rangeland management because they eat noxious weeds.
Plant Foods: leaves; roots and tubers; wood, bark, or stems
Primary Diet: herbivore (Folivore )
Antilocapra americana is endemic to North America and distributed throughout the treeless plains, basins, and deserts of western North America, from the southern prairie provinces of Canada, southward into the western United States and to northern Mexico. Distribution of populations within this range is discontinuous. In 1959, a population was introduced to Hawaii. However, by 1983 the population was roughly 12 individuals and headed for extinction.
Biogeographic Regions: nearctic (Native )
Pronghorns are primarily found in grassland, sage scrub or chapparal, and desert. The southern portion of their range consists mainly of arid grasslands and open prairies. Throughout the rest of their range they are common in sage scrub and chaparral as well, areas of dense shrubs with tough leaves. Pronghorns are particularly dependent on sage brush for forage in these areas. Pronghorn feed primarily on sage, forbs, and grasses. They have also been known to consume cacti in some areas. There is an overlap in forage preferences with domestic sheep and cattle, so some competition for food occurs. Overgrazing by sheep has been implicated in pronghorn die offs, especially in winter. Pronghorn habitat ranges from sea-level to about 3500 m. Their need for free standing, fresh water varies with the moisture content of the vegetation they consume. They may have to travel a great distance to find a water source. In winter, northern populations depend heavily on sage brush. Pronghorn are commonly found along wind-blown ridges where vegetation has been cleared of snow, although they will dig through snow with their hooves to get to vegetation.
Range elevation: 0 to 3,350 m.
Habitat Regions: temperate ; terrestrial
Terrestrial Biomes: desert or dune ; savanna or grassland ; chaparral
Other Habitat Features: suburban ; agricultural
Female pronghorn have been aged at 16 years in the wild, though they seldom live past 9 years. The most common causes of death are predators, hard winters with deep snow, lack of water, and hunting or car collisions. Pronghorns have been recorded living 11 years in captivity.
Average lifespan
Status: wild: 16 years.
Range lifespan
Status: captivity: 11 (high) years.
Average lifespan
Status: wild: 16 years.
Average lifespan
Status: captivity: 11.8 years.
Average lifespan
Status: wild: 10.0 years.
Average lifespan
Status: wild: 10.0 years.
Average lifespan
Status: captivity: 12.0 years.
Pronghorns are small ungulates with barrel-shaped bodies. Females stand 860 mm at the shoulder and males 875 mm at the should. Females are approximately 1406 mm in body length and males are approximately 1415 mm. The tail is up to 105 mm long and ears are up to 143 mm long. Their body weight is from 35 to 70 kg, depending on sex and age. Their hair is dense and very coarse and is air-filled, providing excellent insulation. Guard hairs are hollow and underlain by finer, shorter underfur. Guard hairs are erectile for heat regulation. As more air becomes trapped in fur, the more they are insulated from external temperatures. Their dorsal fur is a rufous brown and they have creamy underbellies, rumps, and neck patches. Males have short black manes on the neck, from 70 to 100 mm in length, as well as a neck patch and a black stripe that runs across the forehead from horn to horn. Females lack these black facial patches, but have a small mass of black hair around their nose. Their ears are small and point slightly inward at the tip. Pronghorns have a patch of white, erectile fur on their rumps that is visible at great distances. The mucous membranes and eyelashes are coal black. Southern populations are paler in overall color than northern populations. The horns are erect, with a posterior hook and a short anterior prong. The prong gives rise to the common name “pronghorn”. This pronged pattern is unique to this species. The horn is a keratinized sheath, black in color, and is deciduous. Horn sheaths grow over a bony extension of the frontal bone, which is now called the cancellous bone in ungulates. A new sheath forms under the old, which splits and is dropped just after the rut each year. Both sexes have horns, although the horns of females are generally small or absent, and never exceed ear length. Female horns average about 120 mm and the prongs are not prominent. The horn begins to grow at the age of six months and will be shed by 18 months. The maximum horn height for males will occur within 2 to 3 years of age and will average 250 mm, exceeding the length of the ear.
Pronghorn limbs are specialized for cursoriality, giving them enhanced speed and endurance. They are the fastest known New World mammal, traveling at speeds of 98 km/h when sprinting, and can hold a sustained speed of 59 to 65 km/h. The advantages to having speed and endurance include the ability to forage over large areas, to seek new food sources when familiar sources fail, and the ability to escape predators. Pronghorns have unguligrade foot posture, which lengthens the legs by allowing them to stand on the tips of their digits. The length of the radius bone is as long, or longer, than the femur. The ulna is reduced and partially fused to the radius. The clavicle in ungulates has been lost and the scapula has been reoriented to lie flat against the side of their chest where it is free to rotate roughly 20° to 25° in the same plane in which the leg swings. The ulna and radius have been reduced to eliminate the twisting and rotating of the elbow. The reduction of bone and associated muscles in the distal limbs decreases limb weight, giving them more speed. Pronghorns have modified their joints to act as hinges allowing only motion in the line of travel. This has been done by introducing interlocking spines and grooves in their joints. All these adaptations have made pronghorns excel in cursorial locomotion, but they can no longer jump because they have lost the suspension mechanism that cervids have. This explains their apparent fear of fences.
The dental formula of Antilocapra americana is 0/3-0/1-3/3-3/3, where incisors and canines only occur on the lower jaw. Pronghorns have hypsodont crown height; discernable roots do not occur, allowing the cheek teeth to be ever growing. An approximate age when the molars erupt varies slightly; the first comes in at 2 months and the second and third come in around 15 months of age. Replacement of incisors varies as the first is replaced at 15 months, the second at 27, and the third at 39 months. Canines are replaced between 39 and 41 months. Premolars are all replaced at 27 months of age. The sequence of tooth eruption, replacement, and wear is used to estimate the age of pronghorns. Cementum annuli analysis of the first permanent incisor is used for older age classes.
Maximal rate of oxygen intake in pronghorns determines the peak at which the animal can synthesize ATP by aerobic catabolism. This then determines how intensely the animal can exercise. Pronghorns are an extreme example of evolutionary specialization for high oxygen consumption. When comparing body weight to weight-specific consumption of oxygen, pronghorns have values three times higher than the that expected for their body size. This high oxygen consumption makes pronghorns Earth’s fastest sustained runner. Unlike cheetahs, also one of the fastest animals on Earth, pronghorns produce ATP required to run fast aerobically. They have exceptionally large lungs for their body size and exceptional abilities to maintain high rates of blood circulation.
Range mass: 47 to 70 kg.
Average mass: 50-57 kg.
Range length: 1.75 (high) m.
Other Physical Features: endothermic ; homoiothermic; bilateral symmetry
Sexual Dimorphism: male larger; male more colorful; ornamentation
Average basal metabolic rate: 50.973 W.
Fawns or weaker pronghorns are preyed on by coyotes, bobcats, wolves, mountain lions, golden eagles, and other predators within their range. Pronghorns can use their horns to help defend themselves, but they primarily use their speed to escape predators. They are capable of sprints up to 86 km per hour and sustained speeds of 59 to 65 km/hr, making them one of the fastest land mammals. Pronghorns also use their feet in fighting off predators. They have keen eyesight and can spot an object from approximately two miles away. Pronghorns are curious animals and will move towards an intruder until they can detect what it is. If they determine that it is a threat, they will flee. When disturbed, pronghorns erect the white fur on their rumps, which acts to warn others of a disturbance.
Known Predators:
Anti-predator Adaptations: cryptic
Pronghorns are polygynous. Males defend territories from March through the end of the rut in early October. They defend a small harem of females in their territories during that time. Males with territories that contain a water source and have topographic features that help them corner does, do better than males without those features in their territories. Depending on a female's body condition, she will search among territorial males for potential mates. This behavior may last for two to three weeks. Pronghorns have scent glands that emit pheromones to attract or identify mates. These pheromones are important to interactions between sexes. Scent glands are located on either side of the jaw, between the hooves, on the rump, and above the tail. The glands on the neck are larger in males and are thought to be associated with sexual interaction as they are more active during the rutting season. Before mating, a male will approach a female from behind and shake his head to emit pheromones to attract the female. Males also use scent gland secretions to mark tall grasses on territorial boundaries. Males also mark territories with scrapes where they urinate and defecate, using a stereotypes "sniff, paw, urinate, defecate" sequence that may be repeated. Male interactions can include some or all of the following: 1) staring, 2) vocalization by the territory holder (a decrescendo snort-wheeze), 3) approaching an intruder, which can be accompanied by head thrashing, sneezes, and teeth grinding, 4) interacting with an intruder, and 5) chasing, which can be for only a few meters or up to 5 km. Male use of the snort-wheeze vocalization is often accompanied by erection of the mane, rump patches, and the cheek patches. If an intruder does not run away, then the two males walk in parallel to each other in a slow, deliberate manner with their heads held low. If a fight occurs, the males thrust their horns at each other in an attempt to do injury. Males end up in horn-horn or head-head pushing battles in which they try to knock the other off balance. Fights average only about 2 minutes long, but often result in serious injury.
Mating System: polygynous
Breeding occurs from mid-September to October in northern parts of the pronghorn range and from July to October in southern parts of their range. Females ovulate from 4 to 7 ova at the time of mating. These ova quickly travel to the uterus and form blastocysts, where they absorb nutrition for almost a month before implantation. Blastocysts develop long, thread-like walls that begin to twist together and form knots. One quarter to one third of blastocysts die of malnutrition when this knotting reduces the membrane surface area. As many as 7 embryos may still survive this knotted blastocyst stage. However, as the embryos develop, distal embryos are forced into the oviduct, where they perish from lack of nutrition and are reabsorbed. The gestation period is about 252 days and births are synchronous, with all females giving birth within a few days of each other. Females give birth to one or two fawns in the spring, typically they have a single young in their first year of breeding and twins in subsequent years. Females often labor on their sides, but stand as the front legs of the fawn begin to emerge from the vulva. Females and their young form bands in the summer that roam over the territories of one to several males. Pronghorns have 4 inguinal mammary glands. Young are partially weaned by 3 weeks old, at which point they begin to eat vegetation as well. Most female pronghorns breed in their second year, at about 16 months old, although some females can breed as early as 5 months old. Males can breed in their first year, but rarely do because older, dominant males monopolize breeding opportunities. Males typically begin to breed in their third year.
Breeding interval: Pronghorns breed once yearly.
Breeding season: onghorn range and from July to October in southern parts of their range.
Range number of offspring: 1 to 2.
Average gestation period: 252 days.
Average weaning age: 3 weeks.
Range time to independence: 1 to 1.5 years.
Range age at sexual or reproductive maturity (female): 5 (low) months.
Average age at sexual or reproductive maturity (female): 16 months.
Range age at sexual or reproductive maturity (male): 1 to 3 years.
Key Reproductive Features: iteroparous ; seasonal breeding ; gonochoric/gonochoristic/dioecious (sexes separate); sexual ; fertilization ; viviparous
Average birth mass: 3000 g.
Average gestation period: 235 days.
Average number of offspring: 2.
Female pronghorns care for their young from 1 to 1.5 years after birth, after which the young will become independent. At the time of birth, the mother will consume the afterbirth to prevent detection by predators. She also consumes any excrement of the young for the first few weeks of their life to prevent detection by predators. For several days after birth young are weak and unable to keep the pace with adults, so mothers and young rest near a source of water until they gain their strength. Females leave their young in a hidden location in vegetation while they forage, but remain within two miles of them. Within minutes after birth, young pronghorns can stand on their own and they nurse within 2 hours. Within days of birth, young pronghorns can outrun a human and begin to travel and forage with their mother and other females and young in summer bands. Siblings are generally on their own until they begin to travel with their mother. Fawns play extensively in the summer herds, developing strength and dexterity. Male pronghorns do not help in raising offspring.
Parental Investment: precocial ; pre-fertilization (Provisioning, Protecting: Female); pre-hatching/birth (Provisioning: Female, Protecting: Female); pre-weaning/fledging (Provisioning: Female, Protecting: Female); pre-independence (Provisioning: Female)
One of nature’s most amazing migrations is that of the pronghorn antelope. Pronghorn have the second longest land mammal migration in North America, a trek of roughly 150 miles coming in second to the caribou which treks over 3000 miles a year (Kostyal, 2011). Given this elite status, it may be somewhat surprising that pronghorn are considered partially migratory; although some individuals migrate long distances seasonally, others only move a few miles a year (White et al., 2007). The Teton herd, known for their extreme migration, travel from their summer foraging grounds in Grand Teton National Park to their wintering grounds in the Green River Basin, south of Pinedale, Wyoming, ins a three to four day, 150-mile trek (Kostyal, 2011). This path is one of only two long-distance migration routes remaining in the Greater Yellowstone region. The other route, located in Idaho, is a much smaller trek of only 80 miles (Cohn, 2010). No matter how short of a journey, both of these herds face many obstacles along the way. The first threat is weather—which is the main reason for these migrations. The weather is a serious threat due to the fact that once snow hits the ground pronghorn antelope lose their biggest advantage: speed. This affects their survival by making them vulnerable to predators, such as wolves (Kostyal, 2011). In addition, deep snow prevents pronghorn from being able to reach their food. If they do not leave the Grand Teton National Park during winter they have high chance of dying due to starvation, predation, hypothermia, or exhaustion, due to difficulties of movement through the deep snow (Cohn, 2010). Another threat to pronghorn is barb wire fences blocking the migration routes. This is a serious issue since pronghorn antelope are not built for jumping. As a result, pronghorn will typically try to go under the fence, causing severe wounds and sometimes deaths due to entanglement (Kostyal, 2011). The most challenging obstacles are highways and interstates. Biologists will even direct traffic to allow them to migrate safely across the roads (Cohn, 2010). Upon arriving in the Green River Basin, the Teton herd spends their winter foraging on the foliage under the snow. As the snow begins to melt in the spring, the migration back to the Grand Teton National Park is a more drawn out journey which happens over roughly two months (Kostyal, 2011). This allows the pronghorn to slowly regain the strength that winter has drained from them. As they become stronger the obstacles become less life-threatening, which allows them to survive the journey back to the Greater Yellowstone area, only to repeat the process the following fall.
Although this is example showcases some of the hazards on long pronghorn migrations, most pronghorn populations do not migrate (Jacques et al., 2009). Over their winter and summer they only move short distances, as small as 13 miles a year (Jacques et al., 2009). The pronghorn that do make extreme migrations such as the Teton herd do so because of the extreme winter weather that occurs in their summer range (Kostyal, 2011). Pronghorn antelope in other regions are not challenged by the severe winter snow that the Teton herd faces, therefore there is no reason for them to move more than a few miles a year for foraging (Jacques et al., 2009).
This taxon is found in the California Central Valley grasslands, which extend approximately 430 miles in central California, paralleling the Sierra Nevada Range to the east and the coastal ranges to the west (averaging 75 miles in longitudinal extent), and stopping abruptly at the Tehachapi Range in the south. Two rivers flow from opposite ends and join around the middle of the valley to form the extensive Sacramento-San Joaquin Delta that flows into San Francisco Bay.
Perennial grasses that were adapted to cool-season growth once dominated the ecoregion. The deep-rooted Purple Needle Grass (Nassella pulchra) was particularly important, although Nodding Needle Grass (Stipa cernua), Wild Ryes (Elymus spp.), Lassen County Bluegrass (Poa limosa), Aristida spp., Crested Hair-grass (Koeleria pyramidata), Deergrass (Muhlenbergia rigens,), and Coast Range Melicgrass (Melica imperfecta) occurred in varying proportions. Most grass growth occurred in the late spring after winter rains and the onset of warmer and sunnier days. Interspersed among the bunchgrasses were a rich array of annual and perennial grasses and forbs, the latter creating extraordinary flowering displays during certain years. Some extensive mass flowerings of the California Poppy (Eschscholzia californica), Lupines (Lupinus spp.), and Exserted Indian Paintbrush (Castilleja exserta) are found in this grassland ecoregion.
Prehistoric grasslands here supported several herbivores including Pronghorn Antelope (Antilocapra americana), elk (including a valley subspecies, the Tule Elk, (Cervus elaphus nannodes), Mule Deer (Odocoileus hemionus), California ground squirrels, gophers, mice, hare, rabbits, and kangaroo rats. Several rodents are endemics or near-endemics to southern valley habitats including the Fresno Kangaroo Rat (Dipodomys nitratoides exilis), Tipton Kangaroo Rat (Dipodomys nitratoides nitratoides), San Joaquin Pocket Mouse (Perognathus inornatus), and Giant Kangaroo Rat (Dipodomys ingens). Predators originally included grizzly bear, gray wolf, coyote, mountain lion, ringtail, bobcat, and the San Joaquin Valley Kit Fox (Vulpes velox), a near-endemic.
The valley and associated delta once supported enormous populations of wintering waterfowl in extensive freshwater marshes. Riparian woodlands acted as important migratory pathways and breeding areas for many neotropical migratory birds. Three species of bird are largely endemic to the Central Valley, surrounding foothills, and portions of the southern coast ranges, namely, the Yellow-billed Magpie (Pica nuttalli), the Tri-colored Blackbird (Agelaius tricolor EN), and Nuttall’s Woodpecker (Picoides nuttallii).
The valley contains a number of reptile species including several endemic or near-endemic species or subspecies such as the San Joaquin Coachwhip (Masticophis flagellum ruddocki), the Blunt-nosed Leopard Lizard (Gambelia sila EN), Gilbert’s Skink (Plestiodon gilberti) and the Sierra Garter Snake (Thamnophis couchii). Lizards present in the ecoregion include: Coast Horned Lizard (Phrynosoma coronatum NT); Western Fence Lizard (Sceloporus occidentalis); Southern Alligator Lizard (Elgaria multicarinata); and the Northern Alligator Lizard (Elgaria coerulea).
There are only a few amphibian species present in the California Central Valley grasslands ecoregion. Special status anuran taxa found here are: Foothill Yellow-legged Frog (Rana boylii NT); Pacific Chorus Frog (Pseudacris regilla); and Western Spadefoot Toad (Pelobates cultripes). The Tiger Salamander (Ambystoma tigrinum) occurs within this ecoregion.
Although many endemic plant species are recognized, especially those associated with vernal pools, e.g. Prickly Spiralgrass (Tuctoria mucronata). A number of invertebrates are known to be restricted to California Central Valley habitats. These include the Delta Green Ground Beetle (Elaphrus viridis CR) known only from a single vernal pool site, and the Valley Elderberry Longhorn Beetle (Desmocerus californicus dimorphus) found only in riparian woodlands of three California counties.
Vernal pool communities occur throughout the Central Valley in seasonally flooded depressions. Several types are recognized including valley pools in basin areas which are typically alkaline or saline, terrace pools on ancient flood terraces of higher ground, and pools on volcanic soils. Vernal pool vegetation is ancient and unique with many habitat and local endemic species. During wet springs, the rims of the pools are encircled by flowers that change in composition as the water recedes. Several aquatic invertebrates are restricted to these unique habitats including a species of fairy shrimp and tadpole shrimp.
This taxon is found in the Chihuahuan Desert, which is one of the most biologically diverse arid regions on Earth. This ecoregion extends from within the United States south into Mexico. This desert is sheltered from the influence of other arid regions such as the Sonoran Desert by the large mountain ranges of the Sierra Madres. This isolation has allowed the evolution of many endemic species; most notable is the high number of endemic plants; in fact, there are a total of 653 vertebrate taxa recorded in the Chihuahuan Desert.Moreover, this ecoregion also sustains some of the last extant populations of Mexican Prairie Dog, wild American Bison and Pronghorn Antelope.
The dominant plant species throughout the Chihuahuan Desert is Creosote Bush (Larrea tridentata). Depending on diverse factors such as type of soil, altitude, and degree of slope, L. tridentata can occur in association with other species. More generally, an association between L. tridentata, American Tarbush (Flourensia cernua) and Viscid Acacia (Acacia neovernicosa) dominates the northernmost portion of the Chihuahuan Desert. The meridional portion is abundant in Yucca and Opuntia, and the southernmost portion is inhabited by Mexican Fire-barrel Cactus (Ferocactus pilosus) and Mojave Mound Cactus (Echinocereus polyacanthus). Herbaceous elements such as Gypsum Grama (Chondrosum ramosa), Blue Grama (Bouteloua gracilis) and Hairy Grama (Chondrosum hirsuta), among others, become dominant near the Sierra Madre Occidental. In western Coahuila State, Lecheguilla Agave (Agave lechuguilla), Honey Mesquite (Prosopis glandulosa), Purple Prickly-pear (Opuntia macrocentra) and Rainbow Cactus (Echinocereus pectinatus) are the dominant vascular plants.
Because of its recent origin, few warm-blooded vertebrates are restricted to the Chihuahuan Desert scrub. However, the Chihuahuan Desert supports a large number of wide-ranging mammals, such as the Pronghorn Antelope (Antilocapra americana), Robust Cottontail (Sylvilagus robustus EN); Mule Deer (Odocoileus hemionus), Grey Fox (Unocyon cineroargentinus), Jaguar (Panthera onca), Collared Peccary or Javelina (Pecari tajacu), Desert Cottontail (Sylvilagus auduboni), Black-tailed Jackrabbit (Lepus californicus), Kangaroo Rats (Dipodomys sp.), pocket mice (Perognathus spp.), Woodrats (Neotoma spp.) and Deer Mice (Peromyscus spp). With only 24 individuals recorded in the state of Chihuahua Antilocapra americana is one of the most highly endangered taxa that inhabits this desert. The ecoregion also contains a small wild population of the highly endangered American Bison (Bison bison) and scattered populations of the highly endangered Mexican Prairie Dog (Cynomys mexicanus), as well as the Black-tailed Prairie Dog (Cynomys ludovicianus).
The Chihuahuan Desert herpetofauna typifies this ecoregion.Several lizard species are centered in the Chihuahuan Desert, and include the Texas Horned Lizard (Phrynosoma cornutum); Texas Banded Gecko (Coleonyx brevis), often found under rocks in limestone foothills; Reticulate Gecko (C. reticulatus); Greater Earless Lizard (Cophosaurus texanus); several species of spiny lizards (Scelopoprus spp.); and the Western Marbled Whiptail (Cnemidophorus tigris marmoratus). Two other whiptails, the New Mexico Whiptail (C. neomexicanus) and the Common Checkered Whiptail (C. tesselatus) occur as all-female parthenogenic clone populations in select disturbed habitats.
Representative snakes include the Trans-Pecos Rat Snake (Bogertophis subocularis), Texas Blackhead Snake (Tantilla atriceps), and Sr (Masticophis taeniatus) and Neotropical Whipsnake (M. flagellum lineatus). Endemic turtles include the Bolsón Tortoise (Gopherus flavomarginatus), Coahuilan Box Turtle (Terrapene coahuila) and several species of softshell turtles. Some reptiles and amphibians restricted to the Madrean sky island habitats include the Ridgenose Rattlesnake (Crotalus willardi), Twin-spotted Rattlesnake (C. pricei), Northern Cat-eyed Snake (Leptodeira septentrionalis), Yarrow’s Spiny Lizard (Sceloporus jarrovii), and Canyon Spotted Whiptail (Cnemidophorus burti).
There are thirty anuran species occurring in the Chihuahuan Desert: Chiricahua Leopard Frog (Rana chircahuaensis); Red Spotted Toad (Anaxyrus punctatus); American Bullfrog (Lithobates catesbeianus); Canyon Treefrog (Hyla arenicolor); Northern Cricket Frog (Acris crepitans); Rio Grande Chirping Frog (Eleutherodactylus cystignathoides); Cliff Chirping Frog (Eleutherodactylus marnockii); Spotted Chirping Frog (Eleutherodactylus guttilatus); Tarahumara Barking Frog (Craugastor tarahumaraensis); Mexican Treefrog (Smilisca baudinii); Madrean Treefrog (Hyla eximia); Montezuma Leopard Frog (Lithobates montezumae); Brown's Leopard Frog (Lithobates brownorum); Yavapai Leopard Frog (Lithobates yavapaiensis); Western Barking Frog (Craugastor augusti); Mexican Cascade Frog (Lithobates pustulosus); Lowland Burrowing Frog (Smilisca fodiens); New Mexico Spadefoot (Spea multiplicata); Plains Spadefoot (Spea bombifrons); Pine Toad (Incilius occidentalis); Woodhouse's Toad (Anaxyrus woodhousii); Couch's Spadefoot Toad (Scaphiopus couchii); Plateau Toad (Anaxyrus compactilis); Texas Toad (Anaxyrus speciosus); Dwarf Toad (Incilius canaliferus); Great Plains Narrowmouth Toad (Gastrophryne olivacea); Great Plains Toad (Anaxyrus cognatus); Eastern Green Toad (Anaxyrus debilis); Gulf Coast Toad (Incilius valliceps); and Longfoot Chirping Toad (Eleutherodactylus longipes VU). The sole salamander occurring in the Chihuahuan Desert is the Tiger Salamander (Ambystoma tigrinum).
Common bird species include the Greater Roadrunner (Geococcyx californianus), Burrowing Owl (Athene cunicularia), Merlin (Falco columbarius), Red-tailed Hawk (Buteo jamaicensis), and the rare Zone-tailed Hawk (Buteo albonotatus). Geococcyx californianus), Curve-billed Thrasher (Toxostoma curvirostra), Scaled Quail (Callipepla squamata), Scott’s Oriole (Icterus parisorum), Black-throated Sparrow (Amphispiza bilineata), Phainopepla (Phainopepla nitens), Worthen’s Sparrow (Spizella wortheni), and Cactus Wren (Campylorhynchus brunneicapillus). In addition, numerous raptors inhabit the Chihuahuan Desert and include the Great Horned Owl (Bubo virginianus) and the Elf Owl (Micrathene whitneyi).
El berrendo o antílope americanu (Antilocapra americana) ye una especie de mamíferu artiodáctilu de la familia Antilocapridae.[2] Tratar del únicu representante actual de la so familia, anque hasta principios del Pleistocenu cuntaba con numberoses especies. Col pasu del tiempu, toos s'escastaron por diversu causes, dexando al berrendo actual como única muerte de la so presencia.
Magar que son llamaos antílopes americanos nun son verdaderos antílopes.[3] Presenta un marcáu dimorfismu sexual, siendo los machos mayores, con un pesu de 45-60 kg, ente que les femes pesen ente 35 y 45 kg. Difier del restu de rumiantes de cuernos buecos por tener estoxos córneos caducos. Dambos sexos tienen cuernos curvos y empobinaos escontra tres que camuden cada añu, como los venaos, pero nunca s'esprenden de la base ósea qu'hai so la superficie córnea. Estos cuernos son más grandes y tán ramificaos nos machos (125 a 450 mm), ente que les femes tener curtios y ensin ramificaciones (25 a 150 mm).Tanto les femes como los machos tienen una corona de pelo na base de los cuernos y una clina de color negru.
El so llargor corporal ye de 1,30 a 1,50 m, una alzada a la cruz de 70 a 80 cm y la so cola tien un llargor de 10 cm ente qu'el so oreyes tener de 15 cm.
La forma del cuerpu recuerda a los antílopes, yá que al igual qu'ellos, tienen el llombu a mayor altor que los costazos. Les sos estremidaes son delgaes y llargues y nun tienen díxitos llaterales En cuanto a la pelame, ye leonado o berrendo nel llombu, d'onde provien el so nome en castellán, anque pel iviernu escurezse llixeramente. Esclariar nes partes inferiores del cuerpu hasta volvese blancu en cara, gargüelu, banduyu, pates y gluteos. Un elementu característicu d'esta especie, ye la presencia d'un gran llurdiu blancu alredor de la rexón caudal, ta presente en machos, femes y críes, la pelame nesta zona se eriza cuando l'animal presiente dalgún peligru, sirviendo d'alvertencia a otros miembros del grupu. Na parte del pescuezu sobresalen dos bandes blanques alcontraes una al altor del gargüelu y otra debaxo d'ella. Esisten bandes de pelo escuru en ñariz, frente, carriellos, parte posterior del pescuezu y envés de la cola. Les pates tienen cuatro dedos, anque caminen sobre dos.
El berrendo ye propiu de Norteamérica, atopándose dende'l sur de Canadá, al traviés del oeste de los Estaos Xuníos, hasta'l norte de Méxicu (Baxa California, Sonora, Chihuahua y Hidalgo).[1]
El hábitat característicu d'estos animales son los espacios abiertos, como llanures herbales y semidesiertos.
Alimentar mientres gran parte del día de yerbes, parrotales, mofos y n'ocasiones inclusive cactus. Los berrendos mover en grandes grupos, dacuando en menaes de cientos d'animales, especialmente en branu. Los integrantes d'estes menaes son siempres femes coles sos críes y machos nuevos. Los machos adultos o vieyos suelen ser solitarios o viven en pequeños grupos, anque dacuando pueden formar tamién fataos formaos namái por individuos masculinos. En seronda, los machos n'edá reproductora compiten ente sigo lluchando cabeza contra cabeza col fin de ganase'l derechu a reproducise. Al contrariu qu'en munchos otros ungulaos, los machos nun abandonen les menaes de femes y nueves tres la dómina de celu, sinón que se xunen a elles mientres tol iviernu siguiente.
Tres 230 díes de xestación, les femes paren una cría (si ye'l so primer partu) o dos nel mes de xunu. Estos pequeños son de color gris y pesen de 2 a 4 kg. Darréu tres el partu, les femes dixebren a les sos críes y esconder ente la maleza, anque se caltienen vixilantes nes zones próximes y alleguen regularmente pa da-yos de mamar.
Anguaño nun cunten con auténticos depredadores. Son los mamíferos más rápidos de Norteamérica,[4] pudiendo correr a 65 km/h mientres dellos kilómetros, saltando de 3 hasta cuasi 6 metros.[3] La so velocidá máxima rexistrada ye de 98 km/h.[ensin referencies]
Por cuenta de ello, ye raru que muerran preses d'otros animales. Los llobos, coyotes, llobos cervales, pumes y águiles reales pueden matar críes de pocos díes, pero inclusive esto nun ye daqué común, pos los pequeños berrendos pueden pasar hores agazupaos ente la vexetación y ensin realizar movimientu dalgunu que pueda delatalos. A les poques selmanes de nacer dexen d'escondese y siguen a la so madre, siendo yá más rápidos que los sos potenciales cazadores hasta entós.
La posible causa de la velocidá del antílope americanu ye qu'hasta fai apenes 20 milenios sí tenía un depredador del qu'esmolecese de verdá. Nes praderíes americanes habitaben felíns similares al guepardu d'Asia y África, pertenecientes al xéneru estinguíu Miracinonyx, que probablemente algamaben velocidaes similares a ésti (105 km/h en tramos curtios). La velocidá y la resistencia a la carrera desenvolver col fin de da-yos safazu, y cuando los guepardos americanos escastar a finales de la postrera glaciación, los berrendos a cencielles siguieron siendo igual de rápidos qu'hasta entós.
Por cuenta de esta ausencia de depredadores, los antílopes americanos multiplicar ensin problemes mientres el Holocenu, y a la llegada de los primeros europeos formaben menaes de millones d'exemplares nes llanures de Canadá, Estaos Xuníos y Méxicu. Esto camudó cola llamada “conquista del Oeste”. Al igual que los bisontes, los berrendos fueron oxetu d'una brutal matanza a manes de los colonos mientres tol sieglu XIX, morriendo miles cada añu. En 1908, quedaben menos de 20.000 exemplares en tol mundu. Primero que la especie menguara más se dictaron lleis pa protexela a ella y el so hábitat, polo que la población aumentó anguaño hasta cuasi los 3 millones d'animales, siendo especialmente abondosos nes zones protexíes de Wyoming y Colorado. En delles zones la caza volvió ser dexada col fin de controlar l'escesu de población.
Reconócense les siguientes subespecies:[2][5]
AA.VV (2009)“Berrendo (Antilocapra americana)” estrayíu'l 2 d'abril de 2011 de: http://www.conanp.gob.mx/pdf_especies/pace_berrendo.pdf
El berrendo o antílope americanu (Antilocapra americana) ye una especie de mamíferu artiodáctilu de la familia Antilocapridae. Tratar del únicu representante actual de la so familia, anque hasta principios del Pleistocenu cuntaba con numberoses especies. Col pasu del tiempu, toos s'escastaron por diversu causes, dexando al berrendo actual como única muerte de la so presencia.
Amerika haçabuynuzu (lat. Antilocapra americana) - haçabuynuz cinsinə aid heyvan növü.
Amerika haçabuynuzu (lat. Antilocapra americana) - haçabuynuz cinsinə aid heyvan növü.
Antilopenn Amerika (Antilocapra americana) a zo ur bronneg daskirier hag a vev e Norzhamerika.
Ar spesad nemetañ eo er c'herentiad Antilocapridae.
Eil loen douarel vuanañ ar bed eo (betek 88,5 km/h) hag ar c'hentañ war hedoù hir (betek 56 km/h war 6 km).
L'antílop americà (Antilocapra americana) és una espècie d'ungulat nadiu de Nord-amèrica. Es tracta de l'únic representant actual dels antilocàprids, una família d'artiodàctils que fins a principis del Plistocè comptava amb nombroses espècies. Tanmateix, amb el pas del temps totes les altres espècies s'extingiren per diverses causes, deixant l'antílop americà com a únic vestigi de la seva existència.
El nom vulgar de l'antílop americà pot causar confusió, car en realitat no es tracta d'un antílop autèntic (a diferència dels antílops autèntics, l'antílop americà té banyes ramificades que es muden cada any).
L'antílop americà (Antilocapra americana) és una espècie d'ungulat nadiu de Nord-amèrica. Es tracta de l'únic representant actual dels antilocàprids, una família d'artiodàctils que fins a principis del Plistocè comptava amb nombroses espècies. Tanmateix, amb el pas del temps totes les altres espècies s'extingiren per diverses causes, deixant l'antílop americà com a únic vestigi de la seva existència.
El nom vulgar de l'antílop americà pot causar confusió, car en realitat no es tracta d'un antílop autèntic (a diferència dels antílops autèntics, l'antílop americà té banyes ramificades que es muden cada any).
Vidloroh americký (Antilocapra americana) Je to jediný zástupce čeledi vidlorohovitých, který představuje přechod mezi jelenovitými a turovitými. Je jedním z nejrychlejších savců planety. Jsou známy čtyři poddruhy: vidloroh americký (Antilocapra americana americana), vidloroh arizonský (Antilocapra americana mexicana), vidloroh kalifornský (Antilocapra americana peninsularis) a vidloroh sonorský (Antilocapra americana sonoriensis).
Severoameričtí indiáni vidloroha často lovili pro maso, a především pro jemnou kůži, která byla ceněna ještě víc než jelenice. Zhotovovaly se z ní ženské oděvy, mokasíny, váčky a další předměty. Indiáni vidloroha pokládali za druh jelena, svědčí o tom i některé z následujících názvů, např. v kríjštině doslova "malý karibu", lakotštině "světlý jelen" nebo nahuatlu "posvátný jelen".[2]
Vidloroh se vyvíjel v Severní Americe, kde je jedním z nejstarších savců. Z toho důvodu nemá na ostatních světadílech žádné příbuzné.
Tělo je porostlé světle hnědou srstí, břicho a spodní části hlavy a krku jsou bílé. Je-li horko, chlupy se zježí, v zimě zase přilnou k pokožce, aby chránily zvíře před chladem. Ocas je obklopen dlouhými bílými chlupy,v případě ohrožení naježí, čímž varují ostatní vidlorohy. Samci i samice mají vidlicovitě rozvětvené rohy, jejichž konce jsou ohnuté dozadu. Na rozdíl od jiných rohatých sudokopytníků je každoročně shazují, asi do čtyř měsíců jim narůstají nové. Ocas měří okolo 10 cm. Samci se od samic liší černým zakončením čenichu a delšími rohy (až 50 cm).
Vidlorozi mají výborný zrak. Patří mezi nejrychlejší suchozemská zvířata. Jejich maximální rychlost je nicméně předmětem sporů, údaje se pohybují od 70 do 100 km/h.[12][13] Vysokou rychlost (přes 50 km/h) jsou schopni si udržet po mnoho kilometrů. Umožňují jim to velké plíce, objemné srdce a široká průdušnice. Průměrná délka života je deset let.
S vidlorohy se nejčastěji můžeme setkat na Velkých pláních, areál jejich výskytu však zasahuje i do Skalnatých hor a polopouštních oblastí na jihozápadě USA a na severu Mexika.
Vidlorozi jsou přežvýkavci. Jejich jídelníček tvoří traviny a větve keřů, v případě nedostatku i kaktusy. Velmi dobře snášejí žízeň.
Říje probíhá od září do poloviny října, kdy kolem sebe samci vytvoří skupinu tří až čtyř samic. V květnu až červnu se rodí mláďata, většinou dvojčata, která váží přibližně 2 kg. Matka je rozmístí do úkrytů vzdálených od sebe asi 100 m, kam je chodí kojit. Jestliže je jedno mládě napadeno predátorem, druhé tak má šanci uniknout. Samečci mají našedlou srst, jež po třech měsících zhnědne. Do jednoho roku se objevují rohy.
Vidlorozi se sdružují do stád, která v minulosti čítala i několik set jedinců. V době říje se rozptýlí a znovu se shromažďují na začátku zimy. Jsou velmi plaší, když však spatří něco neobvyklého, zvědavost je přinutí prohlédnout si to zblízka.
Vidlorohy potkal podobný osud jako bizony. Když se na americký Západ dostali první běloši, pohybovalo se zde 40–50 milionů těchto zvířat. Za jedno století se početní stavy vidlorohů snížily na 19 000 kusů. Byla přijata přísná opatření na jejich ochranu, díky čemuž se jejich populace začala opět zvětšovat. V současnosti žije v Severní Americe přibližně 400 000 vidlorohů.
Vidloroh americký (Antilocapra americana) Je to jediný zástupce čeledi vidlorohovitých, který představuje přechod mezi jelenovitými a turovitými. Je jedním z nejrychlejších savců planety. Jsou známy čtyři poddruhy: vidloroh americký (Antilocapra americana americana), vidloroh arizonský (Antilocapra americana mexicana), vidloroh kalifornský (Antilocapra americana peninsularis) a vidloroh sonorský (Antilocapra americana sonoriensis).
Gaffelbukken (Antilocapra americana) er den eneste art i slægten Antilocapra, som tillige er den eneste slægt i familien Antilocapridae. Dyret når en længde på 1-1,5 m med en hale på 7,5-18 cm og en vægt på 36-70 kg. Den lever i det vestlige og centrale Nordamerika. Den lever af planter. Om vinteren lever dyret i flokke på over 1000 individer, der dog splittes op om sommeren.
Der Gabelbock (Antilocapra americana), auch als Gabelhornantilope, Gabelantilope, Gabelhorntier, Gabelhornträger oder Pronghorn bekannt, ist ein nordamerikanischer Wiederkäuer der Prärie. Obwohl seine Gestalt an die Antilopen Afrikas und Asiens erinnert, gehört er nicht zu deren Familie der Hornträger. Er bildet die heute monotypische Familie der Gabelhornträger (Antilocapridae) als ihr einziger rezenter Vertreter.
Der Gabelbock ist in etwa so groß wie ein Damhirsch. Er hat eine Kopfrumpflänge von bis zu 150 Zentimetern (der Schwanz ist 8 bis 15 cm lang), eine Körperhöhe von 90 Zentimetern und ein Gewicht von 50 bis 70 Kilogramm. Die Männchen sind etwas größer als die Weibchen (Sexualdimorphismus). Das Fell ist oberseits gelb- bis rotbraun und unterseits bis zu den Flanken weiß gefärbt; weiße Bänder finden sich zudem auf der Vorderseite des Halses und um das Maul herum. Die Männchen haben außerdem eine schwarze Zeichnung im Gesicht und am Hals. Ein Gabelbock kann seine Körperhaare aufrichten. Durch das Aufstellen der weißen Rumpfhaare gibt er ein weithin sichtbares Signal, das in einer Herde als Warnung wahrgenommen wird.
Unterscheidbar sind die Geschlechter auch durch die Hörner. Beim Männchen können sie bis zu 25 cm lang werden (meist sind sie doppelt so lang wie die Ohren) und gabeln sich in ein kurzes nach vorne gerichtetes und ein langes nach oben gerichtetes und etwas zurückgebogenes Ende – von dieser Eigenschaft leitet sich ihr deutscher Name ab. Weibchen haben oft gar keine Hörner; falls doch, dann sind diese niemals länger als die Ohren.
Unter den Sinnesorganen des Gabelbocks kommt dem Auge die größte Bedeutung zu. Durch die Lage der Augen an den Kopfseiten hat ein Gabelbock die Möglichkeit, ein Blickfeld von nahezu 360° zu beobachten. Gehör- und Geruchssinn sind von etwas geringerer Bedeutung, beide sind aber dennoch gut entwickelt. Die Ohren können aufgestellt und in verschiedene Richtungen gewendet werden. Die Nase spielt vor allem beim Erkennen von Reviergrenzen eine Rolle.
Anders als bei anderen Paarhufern fehlen die Afterklauen vollständig, die Gliedmaßen tragen also nur die dritte und die vierte Zehe.
Gabelböcke zeichnen sich durch eine außergewöhnliche Sprungkraft aus. So können sie mit einem einzigen Sprung bis zu sechs Meter vorwärts schnellen.
Der Gabelbock besitzt ein reduziertes Gebiss: im Unterkiefer sind je Kieferhälfte 3 Schneidezähne, 1 Eckzahn, 3 Prämolaren und 3 Molaren ausgebildet, im Oberkiefer fehlen die Schneide- und Eckzähne. Die Zahnformel lautet somit 0.0.3.3 3.1.3.3 {displaystyle {frac {0.0.3.3}{3.1.3.3}}} 
Eine Besonderheit stellen die Hörner dar, die direkt oberhalb des Augenfensters ansetzen. Wie die der Hornträger bestehen sie aus einer knöchernen Grundlage (Schaft), die mit Keratin überzogen ist (Hornscheide). Dabei gabelt sich der Hornschaft beim heutigen Gabelbock selber nicht, nur der Keratinüberzug bildet die beiden Hornspitzen aus. Jedes Jahr werden die Hornscheiden nach der Brunft etwa ab Oktober gewechselt. Nur die Knochenzapfen bleiben zeitlebens bestehen, während die Hornscheide sich ablöst und zu Boden fällt. Darunter hat sich zu diesem Zeitpunkt bereits neue Hornmasse gebildet, die noch mit einem pelzigen Überzug bedeckt ist. Das jährliche Wachstum des Keratinüberzuges ist nach rund zehn Monaten abgeschlossen. In dieser Hinsicht ähnelt der Gabelbock den Hirschen, die ihr Geweih jährlich wechseln, weicht aber markant von den Hornträgern ab, bei denen es nicht zu einem Austausch der Hornscheide kommt. Fossile Vertreter der Gabelhornträger besaßen zum Teil sehr komplexe Hörner mit mehreren oder vielfach gegabelten beziehungsweise in sich gedrehten Schäften. Hier ist unklar, ob es ebenfalls zu einem jährlichen Abrieb der Hornscheide kam. Einige Experten sehen darin ein besonderes Merkmal des heute lebenden Gabelbocks. Die frühesten Gabelhornträger besaßen noch mit Haut überzogene Hörner, was anhand von Blutkanälchen an den Hornschäften nachgewiesen wurde.[4][3]
Der Gabelbock entwickelte sich in den Grasländern Nordamerikas und war einst weit über die Prärie und auch in den Wüsten und Halbwüsten der südwestlichen USA sowie des nordwestlichen Mexiko verbreitet. Er bevorzugt Regionen mit weitem Sichtfeld und einer mosaikartigen Vegetation aus offenen Steppen- und Staudenlandschaften. Ursprünglich über weite Bereiche der Großen Ebenen bis hin zum Saskatchewan River im Norden verbreitet, ist er seit der Besiedlung Nordamerikas durch die Europäer in höhere Gebirgslagen des westlichen Kontinentalteiles zurückgedrängt worden. In den Rocky Mountains kommt er bis in Höhen von 3350 m vor. Generell meidet der Gabelbock geschlossenere Landschaften (siehe auch: Bedrohung und Schutz).[1][2]
Gabelböcke können zu allen Tages- und Nachtzeiten aktiv sein, sind dies jedoch überwiegend während der Dämmerung. Wo die Umstände es erforderlich machen, führen sie jahreszeitliche Wanderungen durch, die über Strecken von bis zu 260 Kilometern[5] führen können. Dies ist beispielsweise in Wüsten notwendig, um Wasserläufe zu suchen, oder in felsigen Gegenden, die im Winter kein ausreichendes Nahrungsangebot haben. Die weitesten untersuchten Wanderungen führen aus dem Grand-Teton-Nationalpark über die Gros Ventre Range zum Oberlauf des Green Rivers in Wyoming.[6]
Im Sommer werden ältere Männchen zu Einzelgängern und versuchen, durch Kämpfe ein Territorium zu erstreiten. In diesem sammeln sie einen Harem um sich. Ein Territorium kann vier Quadratkilometer umfassen und wird durch Urin markiert und somit abgesteckt. Das Männchen ist fortan damit beschäftigt, andere Männchen am Betreten und Weibchen am Verlassen des Territoriums zu hindern. Bei einem Aufeinandertreffen zweier Männchen reichen meistens Drohgebärden mit lauten Schreien und Scheinattacken aus, um über Sieger und Verlierer zu entscheiden. Kommt es doch einmal zum Kampf, können die scharfkantigen Hörner ernsthafte Verletzungen und sogar den Tod verursachen.
Im Herbst und im Winter tun sich all die kleinen Verbände mit einzelgängerischen Männchen zu großen Herden zusammen, die in historischen Zeiten mehrere zehntausend Tiere umfassen konnten, heute jedoch maximal aus wenig mehr als 1000 Tieren bestehen.
Jüngere Männchen, die noch nicht kämpfen können, finden sich zu kleinen Verbänden zusammen; alte Männchen, die zu schwach zum Kämpfen geworden sind, bleiben einzelgängerisch und versuchen, den Revieren der Artgenossen auszuweichen. Die Weibchen leben in Gruppen von etwa 20 Tieren. Nach einer Tragzeit von achteinhalb Monaten sondert sich das Weibchen von der Herde ab und bringt ein bis zwei, sehr selten drei Junge mit einem Geburtsgewicht von etwa drei Kilogramm zur Welt. Diese haben zunächst ein graues Fell, das nach drei Monaten die typischen Farben der Alttiere annimmt. Die ersten drei Tage werden sie in einem Versteck gehalten, und etwa nach einer Woche können junge Gabelböcke selbst rennen. Obwohl sie schon nach drei Wochen Gras zu sich nehmen, werden sie noch fünf bis sechs Monate lang gesäugt. Die Geschlechtsreife erreichen die Weibchen mit 15 bis 16, die Männchen mit etwa 24 Monaten.
Gabelböcke haben eine geringe Lebenserwartung und werden selbst unter günstigen Umständen selten älter als zehn Jahre.
Der Gabelbock ist stark wählerisch in seinem Nahrungsverhalten. Generell ernährt er sich von verschiedenen Pflanzen, vor allem von Kräutern, Blättern, Sprossen und Gräsern. Häufig verbringt ein Tier nur relativ kurze Zeit, etwa eine halbe Minute, an einer Nahrungsressource. Vor allem im Frühjahr und zu Beginn des Sommers bevorzugt der Gabelbock Gras, während er im Herbst und Winter Blätter an Stauden frisst. Bedeutend sind hierbei vor allem Artemisia-Gewächse. In Trockenlandschaften bilden zudem Kakteen einen Teil der Ernährungsgrundlage.[1][2]
Im Laufen können Gabelböcke Geschwindigkeiten von 60 bis 70 km/h erreichen; anhand von gemessenen Schrittlängen wurde sogar eine Geschwindigkeit von 86,5 km/h angenommen.[7] Derart hohe Geschwindigkeiten können über eine Strecke von bis zu fünf Kilometern durchgehalten werden. Eine Distanz von 11 Kilometern können sie in 10 Minuten bei einer Durchschnittsgeschwindigkeit von 65 km/h überwinden. Die Tiere sind also eher Langstreckenläufer als Sprinter. Die körperliche Anpassung an solche Geschwindigkeiten besteht nicht nur in dem schlanken Körperbau und den kräftigen Beinen, sondern auch in einer Vergrößerung von Lungen und Herz – das Herz eines Gabelbocks ist etwa doppelt so groß wie das eines Hausschafs. Weitere Anpassungen bestehen beispielsweise in einer erhöhten Anzahl der Mitochondrien pro Muskelvolumen. Es sind solche Verstärkungen der allgemeinen Säugetierstrukturen – und nicht die Entwicklung neuer Strukturen –, die es dem Gabelbock ermöglichen, einen höheren Sauerstoffanteil aus der Atemluft aufzunehmen und zu verwerten, als es für ein Säugetier seiner Größe zu erwarten ist.[8]
Oft stößt man auf die Aussage, Gabelböcke seien nach dem Gepard die schnellsten Säugetiere der Welt.[8] Hier ist aber die Frage, ob die Höchst- oder die Durchschnittsgeschwindigkeit gemeint ist. Über sehr kurze Distanzen können manche afrikanisch-asiatische Antilopen, wie zum Beispiel die Hirschziegenantilope, die gleiche Geschwindigkeit erreichen. Allerdings sind Gabelböcke die schnellsten Säugetiere des amerikanischen Doppelkontinents und, gemessen über eine Strecke von fünf Kilometern, wahrscheinlich sogar die schnellsten Säugetiere überhaupt.
Die natürlichen Feinde des Gabelbocks sind vor allem der Wolf, der Kojote und der Puma.[7] Diese reißen ob der Schnelligkeit ihrer Beutetiere jedoch meistens nur junge, alte oder kranke Individuen. Durch gezielte Tritte mit den Hinterhufen versuchen Gabelböcke, sich gegen die Angreifer zur Wehr zu setzen, was vor allem bei Kojoten oft Erfolg hat. Als Hauptwaffe gegen Fressfeinde gilt aber ihre Geschwindigkeit. Neben diesen natürlichen Feinden stellt jedoch auch der Mensch eine große Bedrohung für den Gabelbock dar.
Zu den ursprünglichen natürlichen Feinden gehörten unter anderem der Gepard Miracinonyx trumani, der Löwe Panthera atrox und möglicherweise auch der Kurznasenbär.[7] Da die maximale Höchstgeschwindigkeit von 86 km/h weit höher ist als nötig, um den heutigen Jägern zu entkommen, wurde teilweise angenommen, dass der Gabelbock aufgrund von Nachstellungen durch Miracinonyx seine guten Laufeigenschaften entwickelt habe.[7] Dieses mutmaßliche Beispiel einer Koevolution in der Räuber-Beute-Beziehung (auch Red-Queen-Hypothese) lässt sich nach Ansicht zahlreicher Wissenschaftler jedoch nicht belegen: Während schon die frühesten Vertreter der Gabelhornträger vom beginnenden Miozän an vor rund 20 Millionen Jahren aus anatomischen Gründen als extrem schnelle Läufer anzusehen sind, stammt der älteste Nachweis der Katze in Nordamerika erst aus dem ausgehenden Pliozän.[9]
Tayassuidae (Nabelschweine)
Suidae (Echte Schweine)
Camelidae (Kamele)
Hippopotamidae (Flusspferde)
Cetacea (Wale)
Tragulidae (Hirschferkel)
Antilocapridae
Giraffidae (Giraffenartige)
Cervidae (Hirsche)
Moschidae (Moschustiere)
Bovidae (Hornträger)
Der Gabelbock wird als eigenständige Art und monotypische Gattung Antilocapra den Wiederkäuern (Ruminantia) innerhalb der Paarhufer (Artiodactyla) zugeordnet. Dort bildet er zudem die Familie der Gabelhornträger (Antilocapridae).[11] Die nähere Verwandtschaft des Gabelbocks war lange Zeit vollkommen unklar. Obwohl er schon frühzeitig in eine eigene Familie gestellt wurde, wurde er von manchen Autoren bis in die 1980er Jahre als Teil der Hornträger (Bovidae) betrachtet und dort der eigenen Unterfamilie Antilocaprinae zugeordnet. Auf der Basis morphologischer Daten wurde der Gabelbock ursprünglich als Schwesterart der Hirsche (Cervidae) eingeordnet, vor allem aufgrund des Aufbaus des Tränenbeines, der sich bei den beiden Gruppen ähnelt und sie von allen anderen Paarhufern abgrenzt.[12] Genetische Untersuchungen legten dagegen ein Schwestergruppenverhältnis der Moschustiere (Moschidae) und der Hirsche nahe, während der Gabelbock nicht mehr in die nähere Verwandtschaft der Hirsche gestellt wurde.[12][13] Karyologische Analysen ergaben, dass der Gabelbock mit seinen aus 58 Chromosomen bestehenden Genom einen vergleichsweise ursprünglichen Zustand innerhalb der Stirnwaffenträger (Pecora) repräsentiert. Obwohl die Giraffen (Giraffa) mit nur 30 Chromosomen zahlreiche Verschmelzungen im Genom aufweisen, wird eine nahe Verwandtschaft dieser beiden Taxa an der Basis der Pecora angenommen. Die Struktur des X-Chromosoms deutet dabei darauf hin, dass der Gabelbock die Schwesterart der Giraffen sein könnte, alternativ stellen sie – wie hier im Kladogramm dargestellt – die Schwesterart aller übrigen Pecora dar.[14] Die Verschiebung der Antilocapridae an die Basis der Stirnwaffenträger zeigt auf, dass die Ausbildung der mit Keratin überzogenen, knöchernen Hörner eine echte konvergente und nicht nur parallele Entwicklung zu den Hörnern der Boviden ist. Zudem nehmen die Antilocapridae und somit auch der Gabelbock dadurch eine Schlüsselstellung für das Verständnis der Entwicklung der Stirnwaffen bei den Wiederkäuern ein.[3]
Antilocapra
Die Gabelhornträger stellen heute eine monotypische Familie mit dem Gabelbock als einzigem Mitglied dar. Fossil sind aber wenigstens 20 Gattungen mit insgesamt rund 60 Arten bekannt, die alle aus Nordamerika stammen. Der phylogenetische Vorgänger der Antilocapridae ist unbekannt, dürfte aber in asiatischen Paarhufern des Oligozän zu finden sein. Die Unterscheidung der einzelnen Mitglieder der Gabelhornträger erfolgt überwiegend anhand der unterschiedlich gestalteten Hornschäfte, weniger anhand schädel- und skelettanatomischer Merkmale. Da die letzte Revision der Familie im Jahr 1937 erfolgte, wird eine neue angemahnt, die auf Gattungs- und Artebene durchgeführt werden sollte und bei der ebenfalls Merkmale des Skelett- und Schädelbaus mit einzubeziehen wären.[3]
Die Familie teilt sich in zwei Hauptlinien auf. Zur einen gehören die kleineren „Merycodontinae“, die nur 7 bis 10 kg schwer wurden, aber möglicherweise eine paraphyletische Unterfamilie darstellen. Charakterisiert sind sie neben der allgemein geringeren Körpergröße durch schmalere und runde Hornschäfte mit einem oder mehreren knöchernen Graten oder Ringen an der Basis, durch das Vorhandensein der oberen Eckzähne und durch rudimentäre, seitliche Zehen an den Vorderfüßen. Sie kamen vor allem im Unteren Miozän bis zum Beginn des Oberen Miozän vor etwa 20,6 bis 10,3 Millionen Jahren vor. Die spätesten Formen überlappen zeitlich ein wenig mit den Antilocaprinae, der stammesgeschichtlich jüngeren Gruppe mit durchschnittlich größeren Tieren (30 bis 80 kg), die erstmals im Mittleren Miozän vor rund 15 Millionen Jahren auftritt. Deren besondere Merkmale umfassen seitlich abgeflachte Hornschäfte ohne basale Grate, eine Keratinhülle um die Hörner, eine hochkronige Bezahnung und fehlende Seitenstrahlen an den Vorderfüßen. Zudem sind die Metapodien deutlich verlängert und erinnern an jene der Hirsche. Innerhalb der Antilocaprinae bestehen ebenfalls einige Entwicklungslinien. So stellen die Ilingocerotini Formen mit gedrehten Hörnern dar, die entfernt an jene der Kudus erinnern. Die Stockocerotini kennzeichnen wiederum vier bis sechs knöcherne Hornschäfte, die oberhalb der Orbita wachsen. Die Antilocaprini werden durch den Gabelbock repräsentiert. Dessen nächste verwandte Gattung stellt hier Texoceros dar, der im Gegensatz zum Gabelbock einen gegabelten knöchernen Hornschaft besitzt.[15][3] Innerhalb der Gattung Antilocapra ist Antilocapra pacifica die Schwesterart, welche 1991 anhand mehrerer Hornschäfte und Schädelfragmente beschrieben worden war. Gefunden wurden diese im Contra Costa County im US-Bundesstaat Kalifornien, sie können aber nur allgemein in das Pleistozän datiert werden. Die Vertreter dieser Art erreichten etwa die Größe des heutigen Gabelbocks, besaßen aber ausgeprägtere Hörner.[16]
Vom heutigen Gabelbock können je nach Lehrmeinung vier bis sechs Unterarten unterschieden werden, von denen der Status der vier folgenden unumstritten ist:[11]
Die manchmal ebenfalls als Unterarten geführten Antilocapra americana anteflexa und Antilocapra americana oregona sind dagegen wohl Synonyme der Unterart Antilocapra americana americana. Die Erstbeschreibung der Art erfolgte 1815 durch George Ord als Antilope americanus[1] anhand von Individuen aus den Ebenen und dem Hochland entlang des Missouri River in den Vereinigten Staaten.[11] 1818 richtete Ord zudem die Gattung Antilocapra ein und ordnete dieser Antilocapra americana als Typusart zu.[1]
Die einst artenreiche Familie der Gabelhornträger trat erstmals im Unteren Miozän vor rund 20 Millionen Jahren in den Gras- und Savannenlandschaften des westlichen Nordamerika auf. Die Tiere waren schon relativ gut entwickelt und mit ihrem grazilen Körperbau und langen Gliedmaßen von Beginn an an die offenen Landschaften angepasst, sie stellten somit schnellläufige (cursoriale) Paarhufer dar. Hinweise auf phylogenetische Vorgänger gibt es nicht. Da aus Nordamerika keine älteren Stirnwaffenträger bekannt sind, wanderten die Vorläufer der Gabelhornträger möglicherweise aus Eurasien ein. Als nächster Verwandter kann Amphimoschus angesehen werden, der aus zahlreichen Fundstellen des Unteren und Mittleren Miozäns Europas belegt ist. Dieser besaß allerdings keine Stirnwaffen, die Übereinstimmungen zu den Gabelhornträgern finden sich überwiegend im Bau des Innenohrs.[17] Unter den Gabelhornträgern Nordamerikas erschienen zuerst die kleinen „Merycodontinae“, deren Hörner noch mit Haut überzogen waren. Der früheste bekannte Vertreter war Paracosoryx mit einem sehr langen, weit oben gegabelten Gehörn. Andere frühe Formen werden durch Meriamoceros repräsentiert, das kurze, am oberen Ende zu kleinen Schaufeln umgebildete Hörner aufwies. Recht erfolgreich war Ramoceros, das erst vor 10 Millionen Jahren verschwand und ein vielfach gegabeltes, den Geweihen der Hirsche ähnelndes Gehörn besaß. Dieses war aber teilweise asymmetrisch aufgebaut, so dass eine Seite länger war als die andere. Die Typusform der frühen Antilocapridae stellte Merycodus dar, dessen Besonderheit ein gegabelter Hornschaft mit zwei gleich langen Sprossen ist. Da etwas mehr als die Hälfte der aufgefundenen Schädel hornlos ist, gehen Wissenschaftler davon aus, dass weibliche Tiere nicht über Hörner verfügten. Als einer der ersten Vertreter der Gabelhornträger ist Merycodus auch im nördlichen Teil des heutigen Mexikos nachgewiesen.[18] Trotz ihres Vorkommens in offenen Landschaften ernährten sich die frühen Gabelhornträger weitgehend von gemischter Pflanzenkost.[15][3][9]
Im Mittleren Miozän vor rund 15 Millionen Jahren sind dann mit Plioceros, ein kurzhalsiges Tier mit sehr breiten und kurzen Hörnern, die ersten Vertreter der Antilocaprinae mit Keratin überzogenen Hornbildungen nachgewiesen. Plioceros war dabei noch relativ klein, besaß aber schon extrem hochkronige Zähne. Es stellt zudem eine der am weitesten verbreiteten Angehörigen der Gabelhornträger dar und ist von der Westküste des nordamerikanischen Kontinentes bis nach Florida an der Ostküste überliefert. Ein bedeutendes Fundgebiet ist zudem die Ash-Hollow-Formation im Mittleren Westen. Im Oberen Miozän und im Pliozän erreichten die Antilocaprinae ihre größte Vielfalt, sie sind zu jener Zeit mit 9 Gattungen und 30 Arten bekannt. Osbornoceros aus dem Oberen Miozän sah dabei dem heutigen Gabelbock schon ähnlich, besaß aber eher gewundene Hörner. Er gehörte weiterhin zu den ersten Vertretern, die vermehrt hartes Gras zu sich nahmen.[15][3][9]
Im Verlauf des Pliozän begann langsam der Niedergang der Gabelhornträger. Allerdings erschienen zu dieser Zeit mit den Stockocerotini eine Gruppe gedrungener Tiere, die sich dem eiszeitlichen Klima anpassten und die eine heute ausgestorbene Seitenlinie repräsentieren. Der älteste Vertreter aber war Hexameryx, der durch sechs weit zueinander divergierende Hornschäfte, drei an jeder Kopfseite, geprägt war, allerdings bisher nur aus dem Oberen Miozän von Florida bekannt ist.[19] Capromeryx stellt weiterhin eine Form dar, die sich durch eine markante Körpergrößenreduktion auszeichnete. Im Durchschnitt waren Individuen des Oberen Pleistozän rund 14 bis 30 % kleiner als solche des Unteren. Der Verzwergungsprozess verlief dabei isometrisch.[20] Die jeweils zwei Hornschäfte je Kopfseite standen bei Capromeryx sehr eng beieinander und waren Untersuchungen zufolge wohl zusammen von einer Keratinschicht umgeben. Dabei gehört die Gattung zu den häufig aufgefundenen Gabelhornträgern sowohl in den heutigen USA als auch im angrenzenden Mexiko.[21][22] In die gleiche Entwicklungslinie sind auch Hexobelomeryx und Hayoceros zu stellen, die zu den am stärksten angepassten Grasfressern innerhalb der Gabelhornträger gehörten. Das für die Gruppe namengebende Stockoceros wies insgesamt vier gleich lange Hornschäfte, die von beiden Geschlechtern getragen wurden, und weniger hypsodonte Backenzähne auf, es verblieb weitgehend bei der gemischten Pflanzenkost.[23] Zudem gehört Stockoceros zu den spätesten Vertretern der fossilen Gabelhornträger und trat etwa zeitgleich mit den ersten Angehörigen der heutigen Gattung Antilocapra auf. Allein 7 Teilskelette, 55 Schädel und fast 800 weitere Skelettreste sind von dieser fossilen Gattung aus der Papago Springs Cave nahe Sonoita in Arizona bekannt.[24] Während am Ende der Letzten Kaltzeit all diese Arten ausstarben, überlebte der Gabelbock, den es auch bereits im Pleistozän gegeben hatte, als einziger.[15][3]
Für die Indianer der Prärie waren Gabelböcke wertvolle Fleischlieferanten. Da sie ein überaus häufiges Wild waren – noch 1800 gab es etwa 40 Millionen Einzeltiere in der Prärie – spielten sie im indianischen Alltag oft eine große Rolle. Die Westlichen Shoshone kannten eine zeremonielle Gabelbockjagd, die von einem Schamanen eingeleitet wurde. Wie die Bisonjagd hatte die Jagd auf Gabelböcke eine religiöse Dimension. Eine Gruppe Jäger trieb die Tiere mit Hilfe eines Feuers in die Hände einer zweiten Gruppe Jäger, in die Richtung eines Flusses oder in einen zuvor vorbereiteten Korral, ein Fanggehege für wilde Tiere. Die Nördlichen Shoshone hingegen streiften sich Felle von Gabelböcken über und pirschten sich so getarnt möglichst nah an eine Herde heran. Auch nach der Verfügbarkeit des Pferdes war die Gabelbockjagd eine anspruchsvolle Herausforderung, da Gabelböcke schneller als Pferde zu laufen vermögen.
Die Lakota begehrten die Gabelböcke nicht nur wegen ihres Fleisches, sondern auch wegen ihrer Felle, die sie gerne für die Herstellung von Kleidung verwendeten. Den Bestand des Gabelbocks konnten die amerikanischen Ureinwohner mit ihren Jagdmethoden jedoch nicht in nennenswerter Weise beeinträchtigen.
Den europäischen Kolonisten war der Gabelbock lange Zeit unbekannt, bis die Art von Lewis und Clark auf ihrer Expedition (1804–1806) beschrieben wurde. In jener Zeit waren die Grasländer des nordamerikanischen Westens überreich an Großwild wie Bisons und Gabelböcken.
Nach der großflächigen Besiedlung Nordamerikas durch weiße Siedler glich das Schicksal des Gabelbocks dem des Amerikanischen Bison. Sie wurden zunächst wegen ihrer Felle und ihres Fleisches geschossen, später nur noch zum Sport bzw. aus Vergnügen. Aus den fahrenden Zügen entlang der Eisenbahnstrecken schossen Reisende Tausende von Gabelböcken ab, deren Kadaver zu beiden Seiten der Bahnlinien verwesten. Bis 1920 war die Bestandszahl durch unkontrollierte Jagd auf nur noch 20.000 Tiere gesunken. Erst danach wurden Schutzmaßnahmen erlassen, weshalb es heute wieder eine Million Gabelböcke in den USA und in Kanada gibt, so dass die Art als Ganzes nicht als gefährdet gilt.
In Mexiko hat sich der Bestand dagegen nie erholen können. Dort gibt es auch heute nur wenig mehr als 1000 Tiere. Folgerichtig listet die internationale Organisation zur Koordinierung des Naturschutzes (IUCN) die beiden mexikanischen Unterarten als bedroht. Dies sind der Sonora-Gabelbock (A. a. sonoriensis) und der Baja-California-Gabelbock (A. a. peninsularis). Letzterer ist nur auf der Halbinsel Baja California beheimatet und wird als stark bedroht geführt.
Gabelböcke sind für einige bedeutende Infektionskrankheiten der Paarhufer empfänglich. So bilden sie ein Erregerreservoir für das bösartige Katarrhalfieber, BVD/MD und die Epizootic Hemorrhagic Disease (EHD). Daneben besteht eine hohe Empfindlichkeit für Milzbrand, Tollwut und diverse Parasitosen.
Als Beitrag zur Bestandssicherung werden Gabelböcke auch als Zootiere gehalten. Ihre Schreckhaftigkeit und ihre Neigung zur Panik im Umgang mit Menschen stellt hier ein besonderes tierpflegerisches Problem dar. Bei Unterschreitung der Fluchtdistanz reagieren die Tiere nicht selten mit einem kompromisslosen Angriff, der infolge der wirkungsvoll eingesetzten Hörner durchaus gefährlich werden kann. Jegliche Anwendung von Zwangsmaßnahmen kann zu Selbsttraumatisierung oder Stressmyopathie führen. Körperliche Untersuchungen können daher nur unter Sedation oder Narkose erfolgen. Eine wirkungsvolle Narkose ist dabei nur durch hochpotente Betäubungsmittel vom Morphintyp erreichbar. Gabelböcke lassen sich im Zoo nur schwer mit anderen Huftierarten vergesellschaften, schon das Eingliedern handaufgezogener, männlicher Tiere kann aufgrund ihrer Aggressivität zu Konflikten führen. Auch das natürliche Sprung- und Schwimmvermögen der Gabelböcke muss bei der Einrichtung des Geheges berücksichtigt werden. Anders als in freier Wildbahn beträgt die Lebenserwartung der Tiere in Gefangenschaft bis zu 17 Jahre.
Der Gabelbock (Antilocapra americana), auch als Gabelhornantilope, Gabelantilope, Gabelhorntier, Gabelhornträger oder Pronghorn bekannt, ist ein nordamerikanischer Wiederkäuer der Prärie. Obwohl seine Gestalt an die Antilopen Afrikas und Asiens erinnert, gehört er nicht zu deren Familie der Hornträger. Er bildet die heute monotypische Familie der Gabelhornträger (Antilocapridae) als ihr einziger rezenter Vertreter.
Di goobelroom (Antilocapra americana) as en kwetjkauer, di uun Nuurdameerikoo lewet. Hi liket en antiloop, as diar oober ei nai mä. Hi as di iansagst slach uun det famile Antilocapridae.
Di goobelroom (Antilocapra americana) as en kwetjkauer, di uun Nuurdameerikoo lewet. Hi liket en antiloop, as diar oober ei nai mä. Hi as di iansagst slach uun det famile Antilocapridae.
Teotlalmazatl (Antilocapra americana, caxtillantlahtolli:Berrendo) ce chichini yolcatl ochanti ipan teotlalli ahnozo ixtlahuatl.
Η αντιλοκάπρα είναι μηρυκαστικό θηλαστικό της οικογενείας των Αντιλοκαπριδών, της οποίας αποτελεί το μοναδικό σωζόμενο μέλος. Απαντά αποκλειστικά στα ηπειρωτικά των ΗΠΑ και σε μικρό τμήμα του Καναδά και του Μεξικού. Η επιστημονική ονομασία του είδους είναι Antilocapra americana και περιλαμβάνει 5 υποείδη.[1]
Παρόλο που, υπό την στενή έννοια του όρου (sensu stricto), δεν είναι αντιλόπη, η αντιλοκάπρα καταλαμβάνει παρόμοιο οικολογικό θώκο με τις αντιλόπες του Παλαιού Κόσμου, μοιάζει με αυτές και, κάποιες από τις λαϊκές της ονομασίες στις περιοχές όπου απαντά, συμπεριλαμβάνουν τον συγκεκριμένο όρο (βλ. και Ονοματολογία).
Η (νεο-)λατινική ονομασία του γένους, Antilocapra, έχει ελληνική προέλευση, αποτελούμενη από τα επί μέρους συνθετικά antilo[pe] «αντιλόπη» + capra «αίγα» [6] Ο όρος americana στην επιστημονική ονομασία του είδους, παραπέμπει στην ήπειρο, από όπου κατάγεται και διαβιοί το θηλαστικό.
Στην Βόρεια Αμερική, η αντιλοκάπρα αποκαλείται με την λαϊκή ονομασία pronghorn, εκ των συνθετικών prong «περόνη, ακίδα, σουβλί» + horn «κέρατο», δηλαδή «(αυτός που έχει) ακιδωτά, σουβλερά κέρατα». Η ονομασία παραπέμπει στις χαρακτηριστικές μυτερές διακλαδώσεις των κεράτων του θηλαστικού.
Άλλες τοπικές ονομασίες με τις οποίες απαντά η αντιλοκάπρα, είναι: prong buck, pronghorn antelope, cabri ή απλώς antelope, επειδή το θηλαστικό αποτελεί το οικολογικό «ισοδύναμο» των αντιλοπών του Παλαιού Κόσμου, στην Αμερική.[7] Επίσης, στο Μεξικό αποκαλείται berrendo.
Η αντιλοκάπρα αποτελεί μονοτυπικό γένος (Antilocapra) εντός της οικογενείας των Αντιλοκαπριδών (Antilocapridae), επίσης μονοτυπικής, εντός της τάξης των Αρτιοδακτύλων. Αποτελούσε και εξακολουθεί να αποτελεί «γρίφο» για τους συστηματικούς ταξινομικούς και, μέχρι την δεκαετία του 1980 περιλαμβανόταν στην οικογένεια Bovidae. Μελέτη του 2005, τοποθέτησε την οικογένεια Αντιλοκαπρίδες ως «αδελφικό» taxon της οικογενείας των Ελαφιδών (Cervidae), με βάση την συγκριτική ανατομική του δακρυϊκού οστού των μελών τους.[8] Κατοπινές γενετικές μελέτες τοποθέτησαν τις Αντιλοκαπρίδες πλησιέστερα στην οικογένεια των Μοσχιδών (Moschidae).[9] Καρυολογικές αναλύσεις, ωστόσο, έδειξαν μεγάλη συγγένεια με την οικογένεια των Καμηλοπαρδαλιδών (Giraffidae) εντός της υποτάξης των Pecora, ιδιαίτερα με την καμηλοπάρδαλη, βάσει της δομής του φυλογενετικού χρωμοσώματος Χ.[10]. Πάντως, πολλοί είναι εκείνοι που υποστηρίζουν ότι η οικογένεια των Αντιλοκαπριδών εξελίχθηκε εντελώς ανεξάρτητα από τις προαναφερθείσες συγγενικές οικογένειες.[11]
Η αντιλοκάπρα απαντά αποκλειστικά στην Βόρεια Αμερική, ως ενδημικό θηλαστικό των περιοχών όπου κατανέμεται. Η εξάπλωσή της περιλαμβάνει έναν (1) πυρήνα στα δυτικοκεντρικά των Ηνωμένων Πολιτειών, με περιφερειακές θέσεις στα σύνορα με τον Καναδά, τις ΝΔ. ΗΠΑ και το Β. Μεξικό.
Οι αντιλοκάπρες έγιναν γνωστές στον επιστημονικό κόσμο από την Αποστολή των Λιούις και Κλαρκ (The Lewis and Clark Expedition) μεταξύ 1804 και 1806 και, συγκεκριμένα από την περιοχή των ΗΠΑ που, σήμερα, είναι γνωστή ως Νότια Ντακότα. Το φάσμα κατανομής εκτείνεται από τα νότια των πολιτειών Σασκάτσουαν και Αλμπέρτα του Καναδά, στις πολιτείες μεταξύ Μοντάνα και Μινεσότα στα βόρεια των Ηνωμένων Πολιτειών, μέχρι την Αριζόνα, το Β. Τέξας, τις ακτές της Ν. Καλιφόρνιας και την βόρεια Μπάχα Καλιφόρνια Σουρ στα νότια, ενώ μέσα στο Μεξικό περιλαμβάνονται οι περιοχές Β. Σονόρα και Σαν Λουίς Ποτοσί.
Το 1959 έγινε εισαγωγή μικρού πληθυσμού στην Χαβάη, αλλά το 1983, μόνον 12 άτομα είχαν απομείνει εκεί και ο πληθυσμός όδευε προς εξαφάνιση.[12]
Η αντιλοκάπρα διαβιοί κυρίως στα ανοικτά, εκτεταμένα, άδενδρα εδάφη τύπου chaparral και στα λιβάδια μεταξύ 900 και 1.800 μ., αν και μπορούν να παρατηρηθούν μέχρι τα 3.050 μ.,[12] με τους πυκνότερους πληθυσμούς σε περιοχές που δέχονται 25-40 εκ. βροχής ετησίως, περίπου. Το νότιο τμήμα του εύρους κατανομής τους κυριαρχείται κυρίως από άνυδρα βοσκοτόπια και ανοικτά λιβάδια. Τον χειμώνα, ιδιαίτερα οι βόρειοι πληθυσμοί εξαρτώνται σε μεγάλο βαθμό από την παρουσία θάμνων με τους οποίους τρέφονται, γι’ αυτό και κινούνται κατά μήκος των κορυφογραμμών που τις σαρώνουν ισχυροί άνεμοι έτσι, ώστε η βλάστηση να καθαρίζεται από το χιόνι, αν και οι αντιλοκάπρες μπορούν να σκάψουν με τις οπλές τους για να αποκαλύψουν τα φυτά.[13][14] Feldhamer et al
Στην περιοχή της πολιτείας του Όρεγκον, οι αντιλοκάπρες περιπλανώνται στις ανοικτές εκτάσεις που βρίθουν από τους αρωματικούς θάμνους της Artemisia tridentata ενώ, περιστασιακά, απαντούν σε εδάφη με διάσπαρτα κωνοφόρα Juniperus occidentalis και Pinus ponderosa. Την άνοιξη απαντούν και σε εδάφη με αγρωστώδη τύπου Bromus tectorum. Στα ίδια ενδιαιτήματα, η παρουσία ύδατος, -είτε ελεύθερου είτε μέσα στα σαρκώδη φυτά- αποτελεί καθοριστικό παράγοντα για τις εποχικές μετακινήσεις του θηλαστικού. Αυτός είναι ο λόγος που, κατά την διάρκεια του φθινοπώρου και του χειμώνα σε περιόδους με αρκετές βροχοπτώσεις, οι αντιλοκάπρες παρατηρούνται σε ξερικά εδάφη. Αντίθετα, κατά τη διάρκεια των θερμών εποχών και στις περιόδους παρατεταμένης ξηρασίας, απαντούν σε πεδινές περιοχές όχι περισσότερο των 3 χλμ. από κάποια πηγή νερού. Γενικά αποφεύγουν εδάφη με υψηλή βλάστηση (>70 εκ.), όπως και τις εκτεταμένες άγονες και ημιερημικές περιοχές.[4]
Μία (1) εν εξελίξει μελέτη από το Ινστιτούτο Lava Lake και την Εταιρία Διατήρησης της Άγριας Ζωής δείχνει χερσαία διαδρομή μετανάστευσης της αντιλοκάπρας, που καλύπτει περισσότερα από 260 χιλιόμετρα.[15] Η μετανάστευση ξεκινάει από τους πρόποδες της οροσειράς Πάιονιρ της Μοντάνα, διασχίζει το Εθνικό Μνημείο και Καταφύγιο των Κρατήρων της Σελήνης (Craters of the Moon National Monument and Preserve) στο Αϊντάχο, φθάνοντας μέχρι τον Ηπειρωτικό Υδροκρίτη της Αμερικής (Great Divide). Ο Δρ. Σκοτ Μπέργκεν αναφέρει, «αυτή η μελέτη δείχνει ότι, οι αντιλοκάπρες είναι οι αληθινοί μαραθωνοδρόμοι της αμερικανικής δύσης. Με τα νέα αυτά ευρήματα, μπορούμε να επιβεβαιώσουμε ότι το Αϊντάχο υποστηρίζει μια μεγάλη χερσαία μετανάστευση θηλαστικών –ένα ολοένα και πιο σπάνιο φαινόμενο στις ΗΠΑ και σε όλο τον κόσμο».[16]
Η αντιλοκάπρα είναι μέσου μεγέθους, μηρυκαστικό θηλαστικό, με χαρακτηριστικά ενδιάμεσα των γνησίων ελαφιών και των αντιλοπών, κάτι που αντικατοπτρίζεται στην ξεχωριστή ταξινομική θέση της οικογένειας στην οποία ανήκει. Το γενικότερο παρουσιαστικό της «θυμίζει» περισσότερο αντιλόπη, αλλά η δομή και η απόπτωση των κεράτων της χαρακτηρίζουν -μέχρι κάποιο βαθμό- τα ελάφια (βλ. Κέρατα).
Το σώμα της είναι στιβαρό και κάπως «στρουμπουλό», σαφώς πιο ογκώδες από εκείνο μιας γνήσιας αντιλόπης και πολύ λιγότερο κομψό από εκείνο ενός ελαφιού. Η ουρά είναι μικρή, οι κνήμες είναι σχετικά λεπτές και ίσιες, ενώ τα πόδια διαθέτουν μόνον 2 δακτύλους (διδάκτυλη οπλή), χωρίς υπολειπόμενο δάκτυλο (declaw). Το κρανίο, από ραχιαία και κοιλιακή όψη εμφανίζει, γενικά, μορφή ακίδας βέλους, ενώ υπάρχει κενό μεταξύ δακρυικού και ρινικού οστού,[4] με την οβελιαία ακρολοφία να απουσιάζει.[17] Το κεφάλι είναι μεγάλο σε σχέση με το σώμα και οι -επίσης μεγάλοι- οφθαλμοί είναι τοποθετημένοι σε ευρείς, σωληνωτούς οφθαλμικούς κόγχους, οι οποίοι παρέχουν επαρκή μηχανική προστασία στους βολβούς. Η ίριδα είναι μαύρη, ενώ επί πλέον προστασία από την ηλιακή ακτινοβολία παρέχουν οι μεγάλες, παχιές βλεφαρίδες.[17] Η όραση της αντιλοκάπρας είναι εξαιρετικά ανεπτυγμένη, με το οπτικό πεδίο να καλύπτει γωνία 320°, περίπου.[4]
Εκτός από τα κέρατα, η αντιλοκάπρα ξεχωρίζει από τις χαρακτηριστικές λευκές περιοχές στους γλουτούς, τον λαιμό, το στήθος, τις πλευρές και την κοιλιά. Ιδιαίτερα διακριτές είναι οι περιοχές στους γλουτούς, εκατέρωθεν της ουράς, οι οποίες μπορεί να έχουν μήκος 8 εκ. η κάθε μία και, ξεχωρίζουν από μεγάλη απόσταση, κάνοντας έντονο κοντράστ με το υπόλοιπο καφεκόκκινο -στο χρώμα της σκουριάς- τρίχωμα του σώματος. Υπάρχουν διάφορα σκούρα καφέ ή μαύρα σημάδια στο κεφάλι και στον λαιμό, ιδιαίτερα στην περιοχή του μετώπου. Tα μπροστινά πόδια είναι μεγαλύτερα από τα πίσω και υποβαστάζουν το μεγαλύτερο βάρος του σώματος, όταν το ζώο τρέχει με μεγάλη ταχύτητα.[4]
Οι αντιλοκάπρες διαθέτουν, συνήθως, 4 μαστικούς αδένες αλλά έχουν καταγραφεί και άτομα με 6. Σε αντίθεση με τα ελάφια, η αντιλοκάπρα διαθέτει χοληδόχο κύστη, ενώ το στομάχι της είναι 4-χωρο. Τα θηλυκά διαθέτουν δίκερη μήτρα [4] Ως προς την οδόντωση, η αντιλοκάπρα ανήκει στα υψίδοντα (hypsodont) θηλαστικά (σημ. η μύλη των δοντιών έχει μεγάλο ύψος για να ανταποκρίνεται στην εκτεταμένη φθορά λόγω της συνεχούς μάσησης). Η μόνιμη οδοντοφυΐα περιλαμβάνει 32, συνολικά, δόντια με τον εξής οδοντικό τύπο: 0.0.3.3 0.1.3.3 {displaystyle { frac {0.0.3.3}{0.1.3.3}}} 
Το τρίχωμα της αντιλοκάπρας είναι σκληρό με μεγάλα, εξαγωνικά μυελώδη (medullary) κύτταρα, τα οποία είναι γεμάτα με αέρα για την παροχή άριστης μόνωσης.[19] Γενικά, θεωρείται κακής εμπορικής αξίας, κάτι που έχει ωφελήσει το θηλαστικό για ευνόητους λόγους. Το τρίχωμα αποπίπτει κάθε άνοιξη και βρίσκεται σε καλύτερη κατάσταση το καλοκαίρι παρά τον επερχόμενο χειμώνα. Τόσο τα αρσενικά όσο και τα θηλυκά διαθέτουν δύο γλουτιαίους οσμητικούς αδένες (rump scent glands), οι οποίοι παράγουν έκκριμα που, σε συνδυασμό με τα λευκά «μπαλώματα» στους γλουτούς, χρησιμεύει στην ενδοειδική αναγνώριση. Τα αρσενικά διαθέτουν, επί πλέον, δύο υποωτικούς (subauricular) και έναν (1) διάμεσο (median), αδένες, απαραίτητους για την αναπαραγωγική συμπεριφορά.[20] Επίσης, και τα δύο φύλα, διαθέτουν διαδακτυλικούς (interdigital) αδένες, τόσο στα εμπρόσθια όσο και στα οπίσθια πόδια, οι οποίοι παράγουν ειδικό σμήγμα το sebum που διατηρεί τις οπλές σε καλή κατάσταση.[21] Τέλος, τα αρσενικά σηματοδοτούν τον ζωτικό τους χώρο με έκκριμα από αδένες που βρίσκονται μπροστά από τους οφθαλμικούς κόγχους, τους προκογχικούς (preorbital) αδένες.[3]
Ενώ στο είδος δεν παρατηρείται έντονος φυλετικός διμορφισμός, τα αρσενικά (bucks) ξεχωρίζουν από τα θηλυκά (does), επειδή είναι σαφώς βαρύτερα -χωρίς ιδιαίτερη διαφορά στο μήκος και ύψος του σώματος- και επειδή έχουν διαφορετικό παρουσιαστικό στα κέρατα, ενώ υπάρχουν και θηλυκά χωρίς κέρατα (βλ. Δομή κεράτων). Επίσης, τα αρσενικά διαθέτουν χαρακτηριστική μαύρη λωρίδα στην περιοχή του λάρυγγα.
Τα κέρατα της αντιλοκάπρας αποτελούν ιδιάζουσα περίπτωση και είναι από εκείνα τα στοιχεία που συμβάλλουν καθοριστικά στον διαχωρισμό του θηλαστικού από τα υπόλοιπα αρτιοδάκτυλα και την συγκρότηση της ξεχωριστής οικογένειας, Αντιλοκαπρίδες. Συγκεκριμένα, υπάρχουν μεν οι κεράτινες θήκες (sheaths) που περιβάλλουν τον αρχικό οστέινο πυρήνα (core), αλλά αυτές αποπίπτουν κάθε χρόνο. Αυτά τα χαρακτηριστικά είναι ενδιάμεσα μεταξύ των κεράτων των βοοειδών (sensu lato) (που διαθέτουν μόνιμες, μη αποπίπτουσες κεράτινες δομές) και των κεράτων των ελαφιών (που δεν έχουν καθόλου κεράτινες θήκες, αλλά επίσης αποπίπτουν κάθε χρόνο).
Επίσης, υπάρχει χαρακτηριστικός τρόπος διακλάδωσης των κεράτων στις αντιλοκάπρες. To βασικό, μετωπικό στέλεχος των κεράτων εμφανίζει διακλάδωση, σε αντίθεση με το αντίστοιχο των ελαφιών που είναι ακέραιο. Αυτή η διακλάδωση παράγει χαρακτηριστική, πεπλατυσμένη, μυτερή δοκίδα-αποφυάδα των αρσενικών -και μόνον-, η οποία αποκαλείται prong και δίνει την αγγλική ονομασία στην αντιλοκάπρα (βλ. Ονοματολογία). Στην συνέχεια, ο κύριος κλάδος που έχει χρώμα καφέ-μαύρο, καταλήγει σε πολύ μυτερά, λεπτά άκρα που εμφανίζουν καμπύλωση προς τα έσω (introrse) ή προς τα έξω (extrorse). Κέρατα διαθέτουν και πολλά θηλυκά, όχι όμως όλα και, όταν υπάρχουν, είναι μικρά και σπανιότατα φέρουν την χαρακτηριστική ακιδωτή διακλάδωση των αρσενικών. Τα κέρατα της αντιλοκάπρας αποπίπτουν κάθε έτος, έναν (1) μήνα ή περισσότερο μετά τα τελετουργικά και τις διαμάχες ερωτοτροπίας (rut).[17]
Το διαιτολόγιο της αντιλοκάπρας περιλαμβάνει ποικιλία φυτικής ύλης, συμπεριλαμβανομένων εκείνων των φυτών που είναι δυσάρεστα ή και τοξικά για πολλά κατοικίδια ζώα (πρόβατα και βοοειδή), αν και μπορεί να υφίσταται ανταγωνισμός με αυτά για την τροφή. Σε μελέτη που εκπονήθηκε, οι πόες αποτελούσαν το 62%, οι θάμνοι το 23%, και τα αγρωστώδη το 15%,[22] ενώ σε άλλη μελέτη, οι κάκτοι αποτελούσαν το 40%, τα αγρωστώδη το 22%, οι πόες το 20%, και οι θάμνοι το 18% του διαιτολογίου.[23] Οι αντιλοκάπρες μηρυκάζουν την τροφή τους.
Η αντιλοκάπρα είναι το ταχύτερο θηλαστικό στο Δυτικό ημισφαίριο, με σωματοδομή που ανταποκρίνεται στην επίτευξη ταχυτήτων, ικανών για να αποφεύγει με σχετική ευκολία οποιονδήποτε θηρευτή των ενδιαιτημάτων της, εάν δεν αιφνιδιαστεί.
Μερικά από τα δομικά στοιχεία που συμβάλλουν καθοριστικά στην επίτευξη υψηλών ταχυτήτων είναι το μεγάλο μέγεθος της τραχείας, των πνευμόνων και της καρδιάς του θηλαστικού -πάντοτε σε σχέση με το μέγεθος του σώματος. Έτσι, σε συνδυασμό με το γεγονός ότι η αντιλοκάπρα τρέχει με το στόμα ανοικτό, προσλαμβάνει μεγάλες ποσότητες ατμοσφαιρικού αέρα και γίνεται ευκολότερα η ανταλλαγή των αναπνευστικών αερίων με την συμμετοχή του κυκλοφορούντος αίματος. Επίσης, η διαμόρφωση και προστασία των οπλών της αντιλοκάπρας είναι τέτοια, ώστε να υπάρχει ισομερής καταμερισμός του βάρους στον άκρο πόδα και να αποφεύγονται η ολίσθηση και οι τραυματισμοί στο τερέν κατά το τρέξιμο, ενώ απορροφούν και το σοκ του υψηλού σωματικού βάρους.
Το ερειστικό σύστημα είναι εξαιρετικά ελαφρύ, ενώ οι επί μέρους τρίχες του τριχώματός τους είναι κοίλες. Η κερκίδα -δηλαδή τα εμπρόσθια άκρα- είναι ίση ή μεγαλύτερη από το μηριαίο οστό -δηλαδή τα οπίσθια άκρα. Η ωλένη είναι μικρή και μερικώς συντετηγμένη με την κερκίδα, για την εξάλειψη της συστροφής και περιστροφής του αγκώνα. Δεν υφίσταται κλείδα και η ωμοπλάτη έχει διευθετηθεί να βρίσκεται σε οριζόντια θέση σε σχέση με το πλαϊνό τμήμα του στήθους, ελεύθερη να περιστρέφεται κατά 20° έως 25°, στο ίδιο επίπεδο με όλο το άκρο. Οι αρθρώσεις έχουν τροποποιηθεί έτσι, ώστε να ενεργούν ως «μεντεσέδες» (sic) που επιτρέπουν μόνο την κίνηση κατά την συνιστώσα της πορείας. Αυτό έχει γίνει με την εισαγωγή ακανθωτών προεκβολών και αυλακώσεων στις αρθρώσεις.[12]
Ωστόσο, το κύριο στοιχείο της φυσιολογίας του ζώου που είναι καθοριστικό για την επίτευξη υψηλών ταχυτήτων, αλλά και για την διατήρησή τους, είναι η ικανότητα Μέγιστης Πρόσληψης Οξυγόνου (ΜΠΟ, VO2max), πρακτικά, την ικανότητα της αντιλοκάπρας να μπορεί να συνθέτει ATP και να αποκρίνεται στον αερόβιο καταβολισμό. Ενδεικτικό είναι ότι, η ΜΠΟ διαδραματίζει σημαντικό ρόλο στην απόδοση στα αθλήματα αντοχής και η βελτίωσή της αποτελεί έναν από τους πιο σοβαρούς προπονητικούς στόχους ενός αθλητή. Με την αύξηση αυτή οι αθλητές καταφέρνουν να παράγουν το ίδιο έργο με χαμηλότερη ένταση άσκησης.[12]
Μάλιστα, η ύπαρξη ενός θηλαστικού που «χρειάζεται» να τρέχει τόσο γρήγορα σε μιαν οικοζώνη που δεν έχει ζώα-δρομείς υψηλών ταχυτήτων, οδήγησε τους ερευνητές στο συμπέρασμα ότι, κατά το παρελθόν, πρέπει να είχε υπάρξει κάποιος θηρευτής-δρομέας που με την πάροδο των αιώνων εξαφανίστηκε, αφήνοντας κενό τον συγκεκριμένο οικολογικό θώκο. Πράγματι, αυτός ο θηρευτής πρέπει να ήταν ο αμερικανικός γατόπαρδος (Miracinonyx sp.), ο οποίος κάλυπτε θώκο στην Αμερική, αντίστοιχο με εκείνον του αρτίγονου γατόπαρδου στην Αφρική.[2][24]
Η επίτευξη υψηλών ταχυτήτων από τις αντιλοκάπρες συνδυάζεται με ικανότητα διατήρησής τους και αντοχής στην παρατεταμένη ταχύτητα, στοιχείο που τούς παρέχει επί πλέον προστασία από τους θηρευτές που διαβιούν στους ίδιους, με αυτές, οικοτόπους. Η τελική ταχύτητα που μπορεί να πετύχει μια αντιλοκάπρα είναι πολύ δύσκολο να μετρηθεί με ακρίβεια, και ποικίλλει μεταξύ των διαφόρων ατόμων και των συνθηκών κάτω από τις οποίες επιτυγχάνεται, στοιχείο που δυσχεραίνει ή κάνει αδύνατες τις πειραματικές μετρήσεις, ακριβώς όπως συμβαίνει και με τον κορυφαίο δρομέα, τον γατόπαρδο.
Ωστόσο, συγκρινόμενη με τις αντιλόπες του Παλαιού Κόσμου, η αντιλοκάπρα εμφανίζει το μειονέκτημα της αδυναμίας υπερπήδησης εμποδίων. Αυτός είναι ο κύριος λόγος που, σχεδόν πάντοτε, φροντίζει να αναζητά την τροφή της σε μεγάλες, ανοικτές επιφάνειες όπου δεν υπάρχουν φυσικά εμπόδια, όπως βράχοι, δένδρα, υψηλοί θάμνοι κ.λ.π. Μάλιστα, η αδυναμία αυτή οδηγεί τις αντιλοκάπρες να συνηθίζουν να περνούν τους τεχνητούς φράχτες που συναντούν στον δρόμο τους, από το κάτω μέρος, κάτι που σε πολλές περιπτώσεις οδηγεί στον τραυματισμό τους, εάν δεν προλάβουν να ανακόψουν ταχύτητα, ή και τον θάνατό τους εάν ο φράχτης είναι αγκαθωτό συρματόπλεγμα. Γι’ αυτό, το Ίδρυμα Αντιλόπης της Αριζόνα (Arizona Antelope Foundation) έχει προχωρήσει στην διαδικασία αντικατάστασης τουλάχιστον του κάτω τμήματος των ακανθοφόρων συρματοπλεγμάτων, με απλό, ακέραιο σύρμα, για την αποφυγή τέτοιων περιστατικών.[27]
Οι αντιλοκάπρες σχηματίζουν μικτές αγέλες κατά την διάρκεια του χειμώνα. Στις αρχές της άνοιξης, τα κοπάδια διαχωρίζονται, με τα νεαρά αρσενικά να σχηματίζουν ομάδες «εργένηδων», τα θηλυκά να σχηματίζουν τις δικές τους, ξεχωριστές ομάδες και τα ενήλικα αρσενικά να περιφέρονται μοναχικά.[24] Ορισμένες «γυναικείες» ομάδες μοιράζονται την ίδια περιοχή το καλοκαίρι, ενώ και κάποια αρσενικά σχηματίζουν δικές τους, μεταξύ άνοιξης και φθινοπώρου. Στις ομάδες των θηλυκών οι ιεραρχίες φαίνεται να είναι εναλλασσόμενες-κυκλικές,[28] με τα κυρίαρχα θηλυκά να είναι επιθετικά με εκείνα άλλων ομάδων.
Τα ενήλικα αρσενικά είτε υπερασπίζονται έναν μόνιμο ζωτικό χώρο, στον οποίο μπορούν να εισέλθουν θηλυκά, είτε να υπερασπίζονται ένα ήδη σχηματισμένο χαρέμι θηλυκών. Η αντιλοκάπρα μπορεί να αλλάξει τις στρατηγικές ζευγαρώματος ανάλογα με τις περιβαλλοντικές ή «δημογραφικές» συνθήκες.[24] Έτσι, όταν οι βροχοπτώσεις είναι αρκετές, τα ενήλικα αρσενικά τείνουν να είναι εδαφικά και να διατηρούν τα εδάφη τους με οσμητική σήμανση, αρθρώνοντας χαρακτηριστικά μουγκανητά και επιτιθέμενα στους εισβολείς. Σε αυτά τα ενδιαιτήματα, τα εδαφικά αρσενικά έχουν πρόσβαση σε καλύτερους πόρους διατροφής από τα εργένικα αρσενικά.[29]
Τα θηλυκά χρησιμοποιούν, επίσης, διαφορετικές στρατηγικές ζευγαρώματος. Τα περισσότερα θηλυκά καθίστανται «δειγματοληπτικά» (sampling), επισκεπτόμενα πολλά αρσενικά και παραμένοντας με το καθένα από αυτά για μικρό χρονικό διάστημα, πριν την μετάβαση στο επόμενο αρσενικό και, μάλιστα, με αυξανόμενο ρυθμό όσο πλησιάζει ο οίστρος. Υπάρχουν και θηλυκά «προβοκάτορες» (inciting), τα οποία συμπεριφέρονται ως «δειγματοληπτικά» μέχρι τον οίστρο και, στην συνέχεια, υποκινούν συγκρούσεις ανάμεσα στα αρσενικά, παρακολουθώντας τα και, ζευγαρώνοντας κατόπιν με τους νικητές. Πριν από τις «μάχες», τα αρσενικά προσπαθούν να εκφοβίσουν ο ένας τον άλλον. Αν ο εκφοβισμός αποτύχει, εμπλέκουν τα μυτερά τους κέρατα και προσπαθούν να προκαλέσουν τραυματισμό.[12] Τέλος υπάρχουν και τα «ήσυχα» (quiet) θηλυκά, που παραμένουν με ένα (1) μόνον αρσενικό σε μια απομονωμένη περιοχή καθ’ όλη την διάρκεια του οίστρου.[30] Τα θηλυκά διατηρούν αυτή την συμπεριφορά ζευγαρώματος για δύο έως τρεις εβδομάδες, συνολικά.[12]
Όταν «φλερτάρει» ένα θηλυκό σε οίστρο, το αρσενικό την πλησιάζει με χαμηλόφωνα μουγκανητά,[24] κινεί το κεφάλι του πέρα-δώθε και τής δείχνει τα χαρακτηριστικά λευκά σημάδια του προσώπου του.[31] Εάν το θηλυκό είναι δεκτικό, παραμένει ακίνητο, οσμίζεται το έκκριμα των αδένων του αρσενικού, και στη συνέχεια επιτρέπει στο αρσενικό να την γονιμοποιήσει.[24]
Οι αντιλοκάπρες έχουν περίοδο κύησης από 7 έως 8 μήνες, που είναι μεγαλύτερη από εκείνην ενός τυπικού οπληφόρου της Βόρειας Αμερικής. Για παράδειγμα, η κυοφορία του ελαφιού με λευκή ουρά (Odocoileus virginianus), διαρκεί 6 εβδομάδες λιγότερο. Οι αντιλοκάπρες αναπαράγονται στα μέσα Σεπτεμβρίου, και τα νεαρά ελαφάκια που ονομάζονται fawns έρχονται στον κόσμο στα τέλη Μαΐου, με τις γέννες να ολοκληρώνονται από όλα τα θηλυκά, μέσα σε διάστημα λίγων ημερών.[22] Τα νεογέννητα ζυγίζουν 2-4 κιλά, συνήθως 3 κιλά, ενώ δίδυμα ελαφάκια είναι αρκετά συνηθισμένα.[32] Τις πρώτες 21-26 ημέρες περνούν το χρόνο τους κρυπτόμενα στην βλάστηση. Έρχονται σε επαφή με την μητέρα τους μέχρι και 20-25 λεπτά, συνολικά, την ημέρα και αυτό συνεχίζεται ακόμα και όταν σχηματίζουν ομάδες με άλλα νεογέννητα. Οι μητέρες αναλαμβάνουν την πλήρη φροντίδα των μικρών οδηγώντας τα στις περιοχές αναζήτησης τροφής και νερού, καθώς και προστατεύοντάς τα από αρπακτικά ζώα. Σιτίζονται συνήθως τρεις φορές την ημέρα. Η σεξουαλική ωριμότητα των νεαρών αντιλοκαπρών επιτυγχάνεται σε 15-16 μήνες, αν και τα αρσενικά σπάνια αναπαράγονται πριν γίνουν 3 ετών.
Οι κύριοι θηρευτές της αντιλοκάπρας είναι το πούμα, το κογιότ, ο κόκκινος λύγκας και οι λύκοι, ενώ ο χρυσαετός συνηθίζει να επιτίθεται στα νεαρά άτομα. Η διάρκεια ζωής τους είναι γύρω στα 10, σπανίως 15 χρόνια.
Πέρα από το κυνήγι (βλ. Ιστορικό και κατάσταση πληθυσμού), οι μεταναστευτικοί διάδρομοι της αντιλοκάπρας απειλούνται από τον κατακερματισμό των ενδιαιτημάτων και το μπλοκάρισμα των παραδοσιακών οδών. Σε μελέτη που διεξήχθη από το Ινστιτούτο Lava Lake και την Εταιρία Διατήρησης της Άγριας Ζωής σε ένα (1) συγκεκριμένο σημείο της πορείας των θηλαστικών, υπήρχε συμφόρηση (bottleneck) από τα διαβαίνοντα ζώα, αφού το πλάτος διάβασης δεν υπερέβαινε τα 200 μέτρα σε πλάτος.[33]
Επίσης, τα αγκαθωτά συρματοπλέγματα που χρησιμοποιούνται από τους κτηνοτρόφους και αγρότες για την περίφραξη των εδαφών τους, αποτελούν σοβαρό κίνδυνο και, γίνεται προσπάθεια να αντικατασταθούν (βλ. Ταχύτητα). Γενικά, πάντως, δεν υπάρχουν άλλες σοβαρές απειλές, και οι προσπάθειες επικεντρώνονται στα κινδυνεύοντα υποείδη, ιδιαίτερα στο A. a. sonoriensis, κυρίως λόγω της υπερβόσκησης, της κατασκευής δρόμων, τους φράχτες, την ανεπαρκή πρόσβαση στο νερό και, με την λαθροθηρία να είναι πάντοτε παρούσα.[34]
Στο γύρισμα του 20ού αιώνα, τα μέλη της ομάδας για τη διατήρηση της άγριας ζωής, Boone & Crockett Club, κατέληξαν στο συμπέρασμα ότι η εξαφάνιση της αντιλοκάπρας ήταν περισσότερο θέμα χρόνου, παρά ενδεχόμενο. Σε επιστολή μεταξύ μελών αναφέρεται ότι, «η Λέσχη είναι πολύ ανήσυχη για την τύχη της αντιλοκάπρας, που φαίνεται να μειώνεται παντού και γρήγορα». Μέχρι το 1920, το κυνήγι είχε φέρει τους πληθυσμούς του θηλαστικού στο ανησυχητικό επίπεδο των 13.000 ατόμων, περίπου.[2] Ωστόσο, σε άλλη επιστολή μέλους αναφέρεται ότι, «προσωπικά, πιστεύω ότι η αντιλόπη είναι καταδικασμένη, αλλά κάθε προσπάθεια θα πρέπει να γίνει για να σωθεί».
Παρά το γεγονός ότι ο σύλλογος είχε αρχίσει τις προσπάθειές του, μέσω χρηματοδότησης και εμπλουτισμού των καταφυγίων θηραμάτων στο Κάνσας, την Μοντάνα και την Νότια Ντακότα, το μεγαλύτερο μέρος των προσπαθειών αποτύγχανε, κυρίως λόγω των επικίνδυνων περιφράξεων. Το 1927, νέες προσπάθειες κορυφώθηκαν με την δημιουργία του Καταφυγίου Αντιλόπης Τσαρλς Σέλντον στην Β. Νεβάδα. Περίπου 2.900 στρέμματα γης αγοράστηκαν από δύο συμμετέχουσες οργανώσεις που, στην συνέχεια, παραδόθηκαν στην Βιολογική Έρευνα ως καταφύγιο της αντιλκάπρας. Η δωρεά αυτή ενισχύθηκε από την κεντρική κυβέρνηση προσθέτοντας 30.000 στρέμματα δημόσιας γης γύρω από το Καταφύγιο. Στις 26 Ιανουαρίου 1931, ο πρόεδρος Χούβερ υπέγραψε την αναδοχή εξαγοράς γης, και στις 31 Δεκεμβρίου 1936 ο πρόεδρος Ρούσβελτ υπέγραψε εκτελεστικό διάταγμα δημιουργίας ενός πολύ μεγάλου καταφυγίου, έκτασης 549.000 στρεμμάτων. Αυτή ήταν η πραγματική αρχή για την ανάκτηση των πληθυσμών της αντιλοκάπρας στην Βόρεια Αμερική.[35]
Η προστασία των οικοτόπων και οι περιορισμοί στο κυνήγι επέτρεψαν στους πληθυσμούς της αντιλοκάπρας να επανέλθουν οριστικά στα, κατ' εκτίμησιν 500.000-1.000.000 άτομα, όχι όμως για όλα τα υποείδη (βλ. Πίνακα υποειδών). Μια πρόσφατη πτώση είχε παρατηρηθεί σε λίγους, εντοπισμένους πληθυσμούς, λόγω κάποιας μορφής καταρροϊκού πυρετού, ο οποίος μεταδίδεται από τα πρόβατα, αλλά η συνολική τάση είναι θετική δεδομένου ότι τα μέτρα διατήρησης, τέθηκαν σε εφαρμογή.
Σήμερα, οι αριθμοί της αντιλοκάπρας είναι πλέον αρκετά μεγάλοι και, μάλιστα ξεπερνούσαν εκείνους των κατοίκων σε κάποιες, απομονωμένες περιοχές στο Ουαϊόμινγκ και το Β. Κολοράντο, μέχρι πρόσφατα. Οι αντιλοκάπρες θηρεύονται νόμιμα στις δυτικές πολιτείες, με σκοπό τον έλεγχο του πληθυσμού, αλλά και ως πηγή τροφής. Οι πληθυσμοί της αντιλοκάπρας παραμένουν σταθεροί, γι’ αυτό και η IUCN έχει κατατάξει το είδος στα Ελαχίστης Ανησυχίας (LC).[5]
Η αντιλοκάπρα είναι μηρυκαστικό θηλαστικό της οικογενείας των Αντιλοκαπριδών, της οποίας αποτελεί το μοναδικό σωζόμενο μέλος. Απαντά αποκλειστικά στα ηπειρωτικά των ΗΠΑ και σε μικρό τμήμα του Καναδά και του Μεξικού. Η επιστημονική ονομασία του είδους είναι Antilocapra americana και περιλαμβάνει 5 υποείδη.
Παρόλο που, υπό την στενή έννοια του όρου (sensu stricto), δεν είναι αντιλόπη, η αντιλοκάπρα καταλαμβάνει παρόμοιο οικολογικό θώκο με τις αντιλόπες του Παλαιού Κόσμου, μοιάζει με αυτές και, κάποιες από τις λαϊκές της ονομασίες στις περιοχές όπου απαντά, συμπεριλαμβάνουν τον συγκεκριμένο όρο (βλ. και Ονοματολογία).
Η αντιλοκάπρα αποτελεί ένα, κατά κάποιο τρόπο, «ζωντανό απολίθωμα». Το γένος αποτελείτο από 12 είδη κατά την διάρκεια του Πλειστόκαινου, στην περιοχή όπου σήμερα εκτείνεται η Βόρεια Αμερική. Με την πάροδο των αιώνων άρχισαν να εξαφανίζονται και, με την άφιξη του ανθρώπου, μόνον 5 είχαν απομείνει, τα οποία εξαφανίστηκαν και αυτά πλην ενός (1), του αρτίγονου Antilocapra americana. Μάλιστα, οι Αντιλοκαπρίδες αποτελούν την μοναδική οικογένεια θηλαστικών που είναι ενδημική στην οικοζώνη της Νεαρκτικής.ပရောင်းဟွန်းတောဆိတ်ကို အမေရိကန်တောဆိတ်ဟုလည်း ခေါ်တွင်သည်။ တောဆိတ် (အန်တီလုပ်) အစစ် မဟုတ်သော်လည်း အခြား ကျွဲ နွားမျိုးနှင့်စာလျှင် တောဆိတ် (အန်တီလုပ်) နှင့်ပို၍ နီးစပ်သည်။ ကမ္ဘာဟောင်းမှ တောဆိတ် (အန်တီလုပ်) အစစ်များနှင့် များစွာဆင်တူသည်။ မြောက်အမေရိကတိုက်၏ အနောက်ပိုင်းနှင့် အလယ်ပိုင်းဒေသတို့၏ ကုန်းတွင်းပိုင်းတွင် တွေ့ရသည်။ [၁]
ဦးချိုသည် ခေါင်းပွဖြစ်၏။ ဦးချို အဖျားဘက်တွင် သမင်ဦးချိုကဲ့သို့ ခွလျက်ရှိသည်။ ထိုတောဆိတ်သည် သမင်မျိုးကဲ့သို့ နှစ်တိုင်း ဦးချိုလဲသည်။ အမြင့်မှာ မြေကြီးမှ ပခုံးစွန်းထိ ၃ ပေပင် မပြည့်တတ်ချေ။ အမွေးအရောင်မှာ ညိုဝါရောင်ဖြစ်သည်။ မျက်နှာတွင် အမည်းကွက်များရှိ၍ လည်ပင်း၊ ရင်ပိုင်းနှင့် ဘေးဘက်များတွင် အဖြူကွက်တစ်ကွက်စီရှိသည်။ ထိုတောဆိတ်သည် အငြိမ်မနေတတ်ဘဲ အမြဲရွေ့ရှားသွားလာနေလေ့ရှိသည်။[၂]
ကနေဒါနိုင်ငံ ဆက်စကာချီဝမ်ပြည်နယ်နှင့် အယ်လ်ဘာတာပြည်နယ်တို့မှသည် တောင်ဘက်သို့ အမေရိကန်ပြည်ထောင်စု အနောက်ပိုင်း(မင်နီဆိုတာပြည်နယ်အနောက်တောင်ပိုင်းနှင့် တက္ကဆက်ပြည်နယ်အလယ်ပိုင်းမှသည် ကယ်လီဖိုးနီးယားပြည်နယ်အလယ် ပိုင်းအထိ) နှင့် မက္ကဆီကိုနိုင်ငံမြောက်ပိုင်းအထိ တွေ့ရသည်။ [၃] [၄] [၅] [၆]
ပရောင်းဟွန်းတောဆိတ်ကို အမေရိကန်တောဆိတ်ဟုလည်း ခေါ်တွင်သည်။ တောဆိတ် (အန်တီလုပ်) အစစ် မဟုတ်သော်လည်း အခြား ကျွဲ နွားမျိုးနှင့်စာလျှင် တောဆိတ် (အန်တီလုပ်) နှင့်ပို၍ နီးစပ်သည်။ ကမ္ဘာဟောင်းမှ တောဆိတ် (အန်တီလုပ်) အစစ်များနှင့် များစွာဆင်တူသည်။ မြောက်အမေရိကတိုက်၏ အနောက်ပိုင်းနှင့် အလယ်ပိုင်းဒေသတို့၏ ကုန်းတွင်းပိုင်းတွင် တွေ့ရသည်။
The pronghorn (UK: /ˈprɒŋhɔːrn/, US: /ˈprɔːŋ-/)[4] (Antilocapra americana) is a species of artiodactyl (even-toed, hoofed) mammal indigenous to interior western and central North America. Though not an antelope, it is known colloquially in North America as the American antelope, prong buck, pronghorn antelope and prairie antelope,[5] because it closely resembles the antelopes of the Old World and fills a similar ecological niche due to parallel evolution.[6] It is the only surviving member of the family Antilocapridae.[7]
During the Pleistocene epoch, about 11 other antilocaprid species existed in North America.[8] Three other genera (Capromeryx,[9][10] Stockoceros[11][12] and Tetrameryx[13]) existed when humans entered North America but are now extinct.
As a member of the superfamily Giraffoidea, the pronghorn's closest living relatives are the giraffe and okapi.[14] The Giraffoidea are in turn members of the infraorder Pecora, making pronghorns more distant relatives of the Cervidae (deer) and Bovidae (cattle, goats, sheep, antelopes, and gazelles), among others.
The pronghorn is the fastest land mammal in the Western Hemisphere, with running speeds of up to 88.5 km/h (55 mph). It is the symbol of the American Society of Mammalogists.[15]
Prior to the arrival of the Europeans, the pronghorn was particularly abundant in the region of the Plains Indians and the region of the indigenous people of the Northwest Plateau and was hunted as a principal food source by the local tribes.[16] The pronghorn has also featured prominently in Native American mythology and oral history.[17]
The scientific name of the pronghorn is Antilocapra americana. Although first seen and described by Spanish explorers in the 16th century, the species was not formally recorded or scrutinized until the expedition in 1804-06 by Captain Meriwether Lewis and Second Lieutenant William Clark.[18] Following the discovery of a few subspecies of the sharp-tailed grouse, Lewis and Clark came across the pronghorn near the mouth of the Niobrara River, in present-day Nebraska. Clark was among the first Euro-Americans to publish the experience of killing a pronghorn, and described his experience as follows:[19]
I walked on shore to find an old Vulcanoe [the Ionia Volcano?] ... in my walk I killed a Buck Goat of this Countrey, about the height of the Grown Deer, its body Shorter the horns which is not very hard and forks 2⁄3 up one prong Short the other round & Sharp arched, and is immediately above its Eyes the Color is a light gray with black behind its ears down the neck, and its face white round its neck, its Sides and its rump round its tail which is Short & white; Verry actively made, has only a pair of hoofs to each foot, his brains on the back of his head, his Nostrals large, his eyes like a Sheep he is more like the Antilope or Gazelle of Africa than any other Species of Goat.
Lewis and Clark made several other observations on the behavior of the pronghorn and how the local tribes hunted them. They described the animal, which they referred to as the "Antelope" or the "Goat", as follows:[20]
Of all the animals we have seen the Antelope seems to possess the most wonderful fleetness. Shy and timorous they generally repose only on the ridges, which command a view of all the approaches of an enemy ... When they first see the hunters they run with great velocity ... The Indians near the Rocky Mountains hunt these animals on horseback, and shoot them with arrows. The Mandans' mode of hunting them is to form a large, strong pen or fold, from which a fence made of bushes gradually widens on each side. The animals are surrounded by the hunters, and gently driven towards this pen, in which they imperceptibly find themselves enclosed, and are then at the mercy of the hunters.
The pronghorn was first officially described by American ornithologist George Ord in 1815.[20]
Pronghorns have distinct white fur on their rumps, sides, breasts, bellies, and across their throats. Adult males are 1.3–1.5 m (4 ft 3 in – 4 ft 11 in) long from nose to tail, stand 81–104 cm (2 ft 8 in – 3 ft 5 in) high at the shoulder, and weigh 40–65 kg (88–143 lb). The females are the same height as males, but weigh 34–48 kg (75–106 lb). The feet have two hooves, with no dewclaws. Their body temperature is 38 °C (100 °F).[8][21][22][23]
The orbits (eye sockets) are prominent and set high on the skull. Their teeth are hypsodont, and their dental formula is 0.0.3.33.1.3.3.
Each horn of the pronghorn is composed of a slender, laterally flattened blade of bone which is thought to grow from the frontal bones of the skull, or from the subcutaneous tissues of the scalp, forming a permanent core.[24] As in the Giraffidae, skin covers the bony cores, but in the pronghorn, it develops into a keratinous sheath which is shed and regrown annually. Unlike the horns of the family Bovidae, the horn sheaths of the pronghorn are branched, each sheath having a forward-pointing tine (hence the name pronghorn). Males have a horn sheath about 12.5–43 cm (5–17 in) (average 25 cm or 10 in) long with a prong. Females have smaller horns that range from 3–15 cm (1–6 in) (average 12 cm or 4+1⁄2 in) and sometimes barely visible; they are straight and very rarely pronged.[22] Males are further differentiated from females in having a small patch of black hair at the angle of the mandible. Pronghorns have a distinct, musky odor. Males mark territory with a preorbital scent gland which is on the sides of the head.[8] They also have very large eyes with a 320° field of vision. Unlike deer, pronghorns possess a gallbladder.[25]
The pronghorn is the fastest land mammal in the Western Hemisphere, being built for maximum predator evasion through running. The top speed is dependent upon the length of time over which it is measured. It can run 56 km/h (35 mph) for 6.5 km (4 mi), 68 km/h (42 mph) for 1.5 km (1 mi), and 88.5 km/h (55 mph) for 800 m (1⁄2 mi).[21][26] Although it is slower than the African cheetah,[27] it can sustain top speeds much longer than cheetahs.[7] The pronghorn may have evolved its running ability to escape from now-extinct predators such as the American cheetah, since its speed greatly exceeds that of all extant North American predators.[7][28]: 318 Compared to its body size, the pronghorn has a large windpipe, heart, and lungs to allow it to take in large amounts of air when running. Additionally, pronghorn hooves have two long, cushioned, pointed toes which help absorb shock when running at high speeds.[29] They also have an extremely light bone structure and hollow hair.
Pronghorns are built for speed, not for jumping. Since their ranges are sometimes affected by sheep ranchers' fences, they can be seen going under fences, sometimes at high speed. For this reason, the Arizona Antelope Foundation and others are in the process of removing the bottom barbed wire from the fences, and/or installing a barbless bottom wire.[30]
The pronghorn has been observed to have at least 13 distinct gaits, including one reaching nearly 7.3 m (23 ft 11 in) per stride.[7]

The present-day range of the pronghorn extends from southern Saskatchewan and Alberta in Canada south into the United States through Montana, Idaho, Utah, Nevada, Arizona, Nebraska, Wyoming, Colorado, New Mexico, Washington, and central Texas west to coastal southern California[31][32] and northern Baja California Sur, to Sonora and San Luis Potosí in northern Mexico.[8][33] They have been extirpated from Iowa and Minnesota in the United States and from Manitoba in Canada.[34]
A subspecies known as the Sonoran pronghorn (A. a. sonoriensis) occurs in Arizona and Mexico.[22] Other subspecies include the Mexican pronghorn (A. a. mexicana), the Oregon pronghorn (A. a. oregona), and the critically endangered Baja California pronghorn (A. a. peninsularis).
Pronghorns prefer open, expansive terrain at elevations varying between 900 and 1,800 m (3,000 and 5,900 ft), with the densest populations in areas receiving around 250–400 mm (10–15+1⁄2 in) of rainfall per year. They eat a wide variety of plant foods, often including plants unpalatable or toxic to domestic livestock, though they also compete with them for food.[21] In one study, forbs comprised 62% of their diet, shrubs 23%, and grasses 15%,[21] while in another, cacti comprised 40%, grass 22%, forbs 20%, and shrubs 18%.[22] Pronghorns also chew and eat (ruminate) cud.
Healthy pronghorn populations tend to stay within 5.0–6.5 km (3–4 mi) of a water source.
An ongoing study by the Lava Lake Institute for Science and Conservation and the Wildlife Conservation Society shows an overland migration route that covers more than 260 km (160 mi).[35] The migrating pronghorn start travel from the foothills of the Pioneer Mountains through Craters of the Moon National Monument to the Continental Divide. Dr. Scott Bergen of the Wildlife Conservation Society says "This study shows that pronghorn are the true marathoners of the American West. With these new findings, we can confirm that Idaho supports a major overland mammal migration - an increasingly rare phenomenon in the U.S. and worldwide."[36]
Cougars (Puma concolor), wolves (Canis lupus), coyotes (Canis latrans), grizzly bears (Ursus arctos horribilis) and bobcats (Lynx rufus) are major predators of pronghorns. Golden eagles (Aquila chrysaetos) have been reported to prey on fawns and adults. Jaguars (Panthera onca) also likely prey on pronghorns in their native range in the southwestern United States and in northern Mexico.
Pronghorns form mixed-sex herds in the winter. In early spring, the herds break up, with young males forming bachelor groups, females forming harems, and adult males living solitarily.[28] Some female bands share the same summer range, and bachelor male bands form between spring and fall. Females form dominance hierarchies with few circular relationships.[37] Dominant females aggressively displace other females from feeding sites.
Adult males either defend a fixed territory that females may enter, or defend a harem of females. A pronghorn may change mating strategies depending on environmental or demographic conditions.[28]: 228 Where precipitation is high, adult males tend to be territorial and maintain their territories with scent marking, vocalizing, and challenging intruders.[38] In these systems, territorial males have access to better resources than bachelor males.[38] Females also employ different mating strategies. "Sampling" females visit several males and remain with each for a short time before switching to the next male at an increasing rate as estrous approaches. "Inciting" females behave as samplers until estrous, and then incite conflicts between males, watching and then mating with the winners.[39] Before fighting, males try to intimidate each other. If intimidation fails, they lock horns and try to injure each other.[22] "Quiet" females remain with a single male in an isolated area throughout estrous.[39] Females continue this mating behavior for two to three weeks.[22]
When courting an estrous female, a male pronghorn approaches her while softly vocalizing[40][28] and waving his head side to side, displaying his cheek patches.[41] The scent glands on the pronghorn are on either side of the jaw, between the hooves, and on the rump.[22] A receptive female remains motionless, sniffs his scent gland, and then allows the male to mount her.[28]
Pronghorns have a gestation period of 7–8 months, which is longer than is typical for North American ungulates. They breed in mid-September, and the doe carries her fawn until late May. The gestation period is around six weeks longer than that of the white-tailed deer. Females usually bear within a few days of each other.[21] Twin fawns are common.[29] Newborn pronghorns weigh 2–4 kg (4–9 lb), most commonly 3 kg (7 lb). In their first 21–26 days, fawns spend time hiding in vegetation.[38] Fawns interact with their mothers for 20–25 minutes a day; this continues even when the fawn joins a nursery.[38] The females nurse, groom, and lead their young to food and water, as well as keep predators away from them.[38] Females usually nurse the young about three times a day.[21] Males are weaned 2–3 weeks earlier than females.[38] Sexual maturity is reached at 15 to 16 months, though males rarely breed until three years old. Their lifespan is typically up to 10 years, rarely 15 years.[21][22][23]
Pronghorn herd, Yellowstone National Park
Doe with fawns about an hour old, near Fort Davis, Texas, 1947. Photo by Smithsonian zoologist Helmut Buechner
Juvenile fawn in New Mexico

At the turn of the 20th century, members of the wildlife conservation group Boone and Crockett Club had determined that the extinction of the pronghorn was likely. In a letter from George Bird Grinnell, Boone and Crockett Club chairman of the game preservation committee, to Walter L. Fisher, Secretary of the Interior, Grinnell stated, "The Club is much concerned about the fate of the pronghorn which appears to be everywhere rapidly diminishing." By the 1920s, hunting pressure had reduced the pronghorn population to about 13,000.[7] Boone and Crockett Club member Charles Alexander Sheldon, in a letter to fellow member Grinnell, wrote, "Personally, I think that the antelope are doomed, yet every attempt should be made to save them." Although the club had begun their efforts to save the pronghorn in 1910 by funding and restocking the Wichita Game Refuge in Oklahoma, the National Bison Range in Montana, and the Wind Cave National Park, in South Dakota, most of the efforts were doomed since experience demonstrated that after initial increases the pronghorns would die off because of the fenced enclosures. In 1927, Grinnell spearheaded efforts along with the help of T. Gilbert Pearson of Grinnell's National Audubon Society to create the Charles Alexander Sheldon Antelope Refuge in northern Nevada. About 2900 acres of land were jointly purchased by the two organizations and subsequently turned over to the Biological Survey as a pronghorn refuge. This donation was contingent upon the government's adding 30,000 acres of surrounding public lands. On June 20, 1929, United States President Herbert Hoover included the required public lands upon request of the Department of Agriculture and the Department of the Interior after learning that the Boone and Crockett Club and the National Audubon Society were underwriting the private land buyout. On January 26, 1931, Hoover signed the executive order for the refuge. On December 31, 1936, President Franklin Roosevelt signed an executive order creating a 222,000-hectare (549,000-acre) tract; this was the true beginning for pronghorn recovery in North America.[42]

The protection of habitat and hunting restrictions have allowed pronghorn numbers to recover to an estimated population between 500,000 and 1,000,000 since the 1930s.[2] Some recent decline has occurred in a few localized populations,[21] due to bluetongue disease which is spread from sheep, but the overall trend has been positive.
Pronghorn migration corridors are threatened by habitat fragmentation and the blocking of traditional routes. In a migration study conducted by Lava Lake Institute for Science and Conservation and the Wildlife Conservation Society, at one point, the migration corridor bottlenecks to an area only 200 yards wide.[43]
Pronghorns are now quite numerous, and outnumbered people in Wyoming and parts of northern Colorado until just recently. They are legally hunted in western states for purposes of population control and food. No major range-wide threats exist, although localized declines are taking place, particularly to the Sonoran pronghorn, mainly as a result of livestock grazing, the construction of roads, fences, and other barriers that prevent access to historical habitat, illegal hunting, insufficient forage and water, and lack of recruitment.[2]
Three subspecies are considered endangered in all (A. a. sonoriensis, A. a. peninsularis), or part of their ranges (A. a. mexicana). The Sonoran pronghorn has an estimated population of fewer than 300 in the United States and 200–500 in Mexico, while there are approximately 200 Peninsula pronghorn in Baja California.[2] Populations of the Sonoran pronghorn in Arizona and Mexico are protected under the Endangered Species Act (since 1967), and a recovery plan for this subspecies has been prepared by U.S. Fish and Wildlife Service.[2] Mexican animals are listed on CITES Appendix I. Pronghorns have game-animal status in all of the western states of the United States, and permits are required to trap or hunt pronghorns.[2]
The pronghorn (UK: /ˈprɒŋhɔːrn/, US: /ˈprɔːŋ-/) (Antilocapra americana) is a species of artiodactyl (even-toed, hoofed) mammal indigenous to interior western and central North America. Though not an antelope, it is known colloquially in North America as the American antelope, prong buck, pronghorn antelope and prairie antelope, because it closely resembles the antelopes of the Old World and fills a similar ecological niche due to parallel evolution. It is the only surviving member of the family Antilocapridae.
During the Pleistocene epoch, about 11 other antilocaprid species existed in North America. Three other genera (Capromeryx, Stockoceros and Tetrameryx) existed when humans entered North America but are now extinct.
As a member of the superfamily Giraffoidea, the pronghorn's closest living relatives are the giraffe and okapi. The Giraffoidea are in turn members of the infraorder Pecora, making pronghorns more distant relatives of the Cervidae (deer) and Bovidae (cattle, goats, sheep, antelopes, and gazelles), among others.
The pronghorn is the fastest land mammal in the Western Hemisphere, with running speeds of up to 88.5 km/h (55 mph). It is the symbol of the American Society of Mammalogists.
La Antilokapro (Antilocapra americana) estas la sola plu vivanta membro de la nearktisa antilokapreda familio kaj la plej rapida terbesto de Nordameriko, kapabla kuri je rapideco de 90 km hore. La antilokapro estas ankaŭ konata kiel antilokapra antilopo, sed ĝi ne estas vera antilopo, kaj ĝia korno konsistas el hareca substanco kiu kreskas ĉirkaŭ osta kerno kaj defalas ĉiujare.
La antilokapro havas pli longan gravedecon ol aliaj nordamerikaj hufuloj. Ĝi pariĝas meze de septembro, kaj la antilokaprino portas sian idon ĝis la malfrua majo, ses semajnojn pli longe ol sia iom pli granda malproksima parenco, la blank-vosta cervo.
Atentigis la (eŭropan) sciencon pri la antilokaproj la Ekspedicio de Lewis kaj Clark, kiu ilin trovis tie kie nun estas Sud-Dakoto (Usono). La vivregiono de la antilokapro etendas de suda Saskaĉevano kaj Alberto en Kanado ĝis Sonoro kaj Kalifornia Duoninsulo en Meksiko. Ili vivas ambaŭflanke de la Rok-Montaro. La orienta limo de ilia vivregiono estas la rivero Misuro en Usono. La subspecio konata kiel Sonora Antilokapro (Antilocapra americana sonoriensis) vivas en Arizono kaj Meksiko.
La antilokaproj unuavice vivas en herba tereno sed ankaŭ vivas en arbusta tereno kaj dezerto. Ili manĝas kaktojn, herbojn, kaj forbojn, kaj ili paŝtiĝas je plantoj.
Novnaskitaj antilokaproj pezas 2 ĝis 4 kg, kaj plenkreskaj virantilokaproj pezas 45 ĝis 60 kg, dum plenkreskaj antilokaprinoj pezas 35 ĝis 45 kg. Laŭ koloro plenkreskuloj estas brunaj aŭ brunetaj, kun blanka postaĵo kaj ventro kaj du blankaj strioj surkole. Mallonga malhela kolhararo kreskas laŭ la kolo, kaj virantilokaproj ankaŭ havas nigran maskon kaj nigrajn makulojn sur la koloflankoj.
Virantilokaproj havas kornojn 12 ĝis 35 cm longaj kun dento. Antilokaprinoj ankaŭ havas kornojn, sed la kornoj estas iom malgrandaj kaj foje apenaŭ videblaj; tiuj kornoj estas de 2,4 ĝis 15 cm longaj kaj estas rektaj, sen dento. La antilokaproj havas apartan, moskecan odoron, kaj virantilokaproj indikas sian terenon per odorglando kiu troviĝas je la flankoj de la kapo; ĝuste ĉi tial (kaj pro ilia simileco al malsovaĝaj kaproj) oni foje nomas la antilokaprojn "preriaj kaproj", rapidkaproj", aŭ simple "kaproj".
La antilokapro estas unu el la plej rapidaj terbestoj; pli rapida ol ĝi estas la gepardo, sed ĝi povas kuri je alta rapideco pli longe ol la gepardoj. La plej alta registrita rapideco de antilokapro estas 98 km hore. Kvankam la antilokapro estas konstruita por rapida kurado, kun grandaj koro kaj pulmoj, ĝi malbone saltas, kaj ilia disvastiĝo estas ofte limigita de la bariloj de ŝafranĉistoj. La antilokapro ankaŭ havas grandajn okulojn, kiuj donas vidpovon ekvivalenta al tiu tra binoklo kun okobla pligrandigo.
Gis la jaro 1908 ĉasado malgrandigis la nombron de antilokaproj ĝis ĉ. 20.000, sed proktekto de ilia vivmedio kaj limigado de ĉasado permesis al ili kreskigis siajn nombrojn ĝis 500.000. Lupoj, kojotoj, kaj linkoj nun estas iliaj ĉefaj predantoj, kvankam ankaŭ oragloj foje predas antilokapridojn.
Antilokaproj estas nun tiel multnombras ke ili estas pli multnombraj ol homoj en Vajomingo kaj en partoj de norda Kolorado. Oni ofte ĉasas antilokaprojn en la okcidentaj ŝtatoj de Usono por limigi iliajn nombrojn kaj por manĝi ilian viandon, kiu estas riĉgusta kaj kun malmulta graso.
Unu subspecio (A. a. sonoriensis) estas konsiderata kritike endanĝerigita [1].
El berrendo o antílope americano (Antilocapra americana) es una especie de mamífero artiodáctilo de la familia Antilocapridae.[2] Se trata del único representante actual de su familia, aunque hasta principios del Pleistoceno contaba con numerosas especies. Con el paso del tiempo, todos se extinguieron por diversas causas, dejando al berrendo actual como único vestigio de su presencia.
Pese a que son llamados antílopes americanos no son verdaderos antílopes.[3] Presenta un marcado dimorfismo sexual, siendo los machos mayores, con un peso de 45-60 kg, mientras que las hembras pesan entre 35 y 45 kg. Difiere del resto de rumiantes de cuernos huecos por tener estuches córneos caducos. Ambos sexos poseen cuernos curvos y dirigidos hacia atrás que mudan cada año, como los ciervos, pero nunca se desprenden de la base ósea que hay bajo la superficie córnea. Estos cuernos son más grandes y están ramificados en los machos (125 a 450 mm), mientras que las hembras los tienen cortos y sin ramificaciones (25 a 150 mm).Tanto las hembras como los machos poseen una corona de pelo en la base de los cuernos y una crin de color negro.
Su longitud corporal es de 1,30 a 1,50 m, una alzada a la cruz de 70 a 80 cm y su cola tiene una longitud de 10 cm mientras que sus orejas la tienen de 15 cm.
La forma del cuerpo recuerda a los antílopes, ya que al igual que ellos, tienen el lomo a mayor altura que los hombros. Sus extremidades son delgadas y largas y no tienen dígitos laterales. En cuanto al pelaje, es leonado o berrendo en el lomo, de donde proviene su nombre en castellano, aunque en invierno se oscurece ligeramente. Se aclara en las partes inferiores del cuerpo hasta volverse blanco en cara, garganta, vientre, patas y glúteos. Un elemento característico de esta especie, es la presencia de una gran mancha blanca alrededor de la región caudal, está presente en machos, hembras y crías, el pelaje en esta zona se eriza cuando el animal presiente algún peligro, sirviendo de advertencia a otros miembros del grupo. En la parte del cuello sobresalen dos bandas blancas localizadas una a la altura de la garganta y otra debajo de ella. Existen bandas de pelo oscuro en nariz, frente, carrillos, parte posterior del cuello y dorso de la cola. Las patas tienen cuatro dedos, aunque caminan sobre dos.
El berrendo es propio de Norteamérica, encontrándose desde el sur de Canadá, a través del oeste de los Estados Unidos, hasta el norte de México (Baja California, Sonora, Chihuahua, Coahuila e Hidalgo).[1]
El hábitat característico de estos animales son los espacios abiertos, como llanuras herbáceas y semidesiertos.
Se alimentan durante gran parte del día de hierbas, arbustos, musgos y en ocasiones incluso cactus. Los berrendos se mueven en grandes grupos, a veces en manadas de cientos de animales, especialmente en verano. Los integrantes de estas manadas son siempre hembras con sus crías y machos jóvenes. Los machos adultos o viejos suelen ser solitarios o viven en pequeños grupos, aunque a veces pueden formar también rebaños formados únicamente por individuos masculinos. En otoño, los machos en edad reproductora compiten entre sí luchando cabeza contra cabeza con el fin de ganarse el derecho a reproducirse. Al contrario que en muchos otros ungulados, los machos no abandonan las manadas de hembras y jóvenes tras la época de celo, sino que se unen a ellas durante todo el invierno siguiente.
Tras 230 días de gestación, las hembras paren una cría (si es su primer parto) o dos en el mes de junio. Estos pequeños son de color gris y pesan de 2 a 4 kg. Inmediatamente tras el parto, las hembras separan a sus crías y las esconden entre la maleza, aunque se mantienen vigilantes en las zonas próximas y acuden regularmente para darles de mamar.
Actualmente no cuentan con auténticos depredadores. Son los mamíferos más rápidos de Norteamérica,[4] pudiendo correr a 65 km/h durante varios kilómetros, saltando de 3 hasta casi 6 metros.[3] Su velocidad máxima registrada es de 98 km/h.[cita requerida]
Debido a ello, es raro que mueran presas de otros animales. Los lobos, coyotes, linces, pumas y águilas reales pueden matar crías de pocos días, pero incluso esto no es algo común, pues los pequeños berrendos pueden pasar horas agazapados entre la vegetación y sin realizar movimiento alguno que pueda delatarlos. A las pocas semanas de nacer dejan de esconderse y siguen a su madre, siendo ya más rápidos que sus potenciales cazadores hasta entonces.
La posible causa de la velocidad del antílope americano es que hasta hace apenas 20 milenios sí tenía un depredador del que preocuparse de verdad. En las praderas americanas habitaban felinos similares al guepardo de Asia y África, pertenecientes al género extinto Miracinonyx, que probablemente alcanzaban velocidades similares a este (105 km/h en tramos cortos). La velocidad y la resistencia a la carrera se desarrollaron con el fin de darles esquinazo, y cuando los guepardos americanos se extinguieron a finales de la última glaciación, los berrendos simplemente siguieron siendo igual de veloces que hasta entonces.
Debido a esta ausencia de depredadores, los antílopes americanos se multiplicaron sin problemas durante el Holoceno, y a la llegada de los primeros europeos formaban manadas de millones de ejemplares en las llanuras de Canadá, Estados Unidos y México. Esto cambió con la llamada “conquista del Oeste”. Al igual que los bisontes, los berrendos fueron objeto de una brutal matanza a manos de los colonos durante todo el siglo XIX, muriendo miles cada año. En 1908, quedaban menos de 20.000 ejemplares en todo el mundo. Antes de que la especie disminuyese más se dictaron leyes para protegerla a ella y su hábitat, por lo que la población ha aumentado en la actualidad hasta casi los 3 millones de animales, siendo especialmente abundantes en las zonas protegidas de Wyoming y Colorado. En algunas zonas la caza ha vuelto a ser permitida con el fin de controlar el exceso de población. En México era cazada habitualmente para alimentar a los mineros del El Boleo, hasta que en 1922 se la convirtió en especie protegida y su caza se volvió ilegal.[5]
Se reconocen las siguientes subespecies:[2][6]
AA.VV (2009)“Berrendo (Antilocapra americana)” extraído el 2 de abril de 2011 de: https://web.archive.org/web/20150923210118/http://www.conanp.gob.mx/pdf_especies/pace_berrendo.pdf
El berrendo o antílope americano (Antilocapra americana) es una especie de mamífero artiodáctilo de la familia Antilocapridae. Se trata del único representante actual de su familia, aunque hasta principios del Pleistoceno contaba con numerosas especies. Con el paso del tiempo, todos se extinguieron por diversas causas, dejando al berrendo actual como único vestigio de su presencia.
Antilocapra americana Antilocapra generoko animalia da. Artiodaktiloen barruko Antilocapridae familian sailkatuta dago.
Antilocapra americana Antilocapra generoko animalia da. Artiodaktiloen barruko Antilocapridae familian sailkatuta dago.
Hanka-antilooppi (Antilocapra americana) on hanka-antilooppien (Antilocapridae) heimon viimeinen elossa oleva laji.[3] Muinoin Amerikassa eli useita lajeja, mutta jo tertiäärikaudella ja sitä seuraavalla kvartäärikaudella hanka-antilooppilajit alkoivat kuolla sukupuuttoon. Ne eivät ilmeisesti onnistuneet sopeutumaan ilmastonmuutoksiin tai ne eivät kestäneet kilpailua kehityskykyisten onttosarvisten kanssa.
Hanka-antiloopit eivät nimestään huolimatta ole läheistä sukua onttosarvisten (Bovidae) heimoon kuuluville antiloopeille, vaan niiden lähimpiä sukulaisia ovat kirahvit ja hirvieläimet.[3] Hanka-antiloopit luokiteltiin aiemmin onttosarvisten heimon alaheimoksi Antilocaprinae, mutta nykyisin ne yleensä erotetaan omaksi heimokseen.[1][3]
Hanka-antilooppi on Pohjois-Amerikan nopein maaeläin. Se pystyy juoksemaan jopa yli 80 km/h, joten se pääse helposti pakoon esimerkiksi susia. Hanka-antiloopit ovat myös hyviä uimareita.
Nykyään hanka-antilooppia pidetään elävänä fossiilina. Menneinä aikoina, eli ennen valkoihoisten saapumista Amerikkaan, nämä eläimet elivät laajalla alueella Pohjois-Amerikan länsiosista ja Etelä-Kanadasta Keski-Meksikoon. Pohjois-Amerikan länsiosan asuttamisen yhteydessä lajin kanta on pudonnut huomattavasti ja sen elinalue on kaventunut. Suojelutoimien ansiosta hanka-antiloopin tilanne on hieman parantunut. Nykyään hanka-antiloopin elinalue käsittää Saskatchewanin eteläosan ja Albertan Kanadassa sekä Yhdysvaltain länsiosissa Preeriatasankojen alueen (Great Plains) ja etelään Meksikon Hidalgoon, Kalifornian niemimaalle ja Länsi-Sonoraan.
Hanka-antiloopin uhanalaisia alalajeja ovat kalifornianhanka-antilooppi (A. americana peninsularis) Kalifornian eteläosissa ja Kalifornian niemimaalla sekä sonoranhanka-antilooppi (A. americana sonoriensis) Arizonan eteläosissa ja Sonoran keski- ja länsiosissa.[3] Molemmat alalajit ovat IUCN:n Punaisessa kirjassa.[2]
Vuonna 1959 hanka-antilooppeja siirtoistutettiin Lanain saarelle Havaijille. 1960-luvun puoliväliin mennessä tämän saaren hanka-antilooppikanta oli kasvanut noin 250 yksilöön. 1980-luvun alussa yksilöitä oli kuitenkin jäljellä enää kymmenkunta, ja nykyisin lajin otaksutaan hävinneen saarelta kokonaan.[1]
Hanka-antilooppi muistuttaa jossakin määrin antilooppia, joskin sillä on aivan erilaiset aivotsäkäkorkeus on 80–100 senttimetriä. Pukit ovat hieman kookkaampia kuin naaraat.
Sekä naaraalla että uroksella on sarvet. Uroksilla ne kasvavat korvien yli ja ovat noin 40 cm:n pituiset. Sarvissa on litteä ydinosa ja vuosittain kiima-ajan jälkeen vaihtuva sarveistuppi.[4] Sarveistupen kasvu kestää suunnilleen neljä kuukautta.
Eläimet viestivät nostamalla peräpään valkoiset karvat pystyyn, jolloin syntyy kauaksi näkyvä merkki.
Hanka-antilooppi (Antilocapra americana) on hanka-antilooppien (Antilocapridae) heimon viimeinen elossa oleva laji. Muinoin Amerikassa eli useita lajeja, mutta jo tertiäärikaudella ja sitä seuraavalla kvartäärikaudella hanka-antilooppilajit alkoivat kuolla sukupuuttoon. Ne eivät ilmeisesti onnistuneet sopeutumaan ilmastonmuutoksiin tai ne eivät kestäneet kilpailua kehityskykyisten onttosarvisten kanssa.
Hanka-antiloopit eivät nimestään huolimatta ole läheistä sukua onttosarvisten (Bovidae) heimoon kuuluville antiloopeille, vaan niiden lähimpiä sukulaisia ovat kirahvit ja hirvieläimet. Hanka-antiloopit luokiteltiin aiemmin onttosarvisten heimon alaheimoksi Antilocaprinae, mutta nykyisin ne yleensä erotetaan omaksi heimokseen.
Hanka-antilooppi on Pohjois-Amerikan nopein maaeläin. Se pystyy juoksemaan jopa yli 80 km/h, joten se pääse helposti pakoon esimerkiksi susia. Hanka-antiloopit ovat myös hyviä uimareita.
Antilocapra americana est la seule espèce du genre Antilocapra, et également la seule représentante actuelle de la famille des antilocapridés (Antilocapridae). Elle est appelée Antilope d'Amérique[1] ou Antilocapre[2] en français, ou encore pronghorn (dénomination anglaise parfois utilisée en français). Ce mammifère vit dans la partie ouest de l'Amérique du Nord, dans des milieux très divers.
Antilocapra americana a une hauteur au garrot comprise entre 0,81 et 1,04 mètre[3]. Avec la tête, elle mesure généralement entre 1 et 1,50 mètre[3]. Sa longueur totale atteint en moyenne 141 cm. Les mâles sont légèrement plus grands que les femelles. Les pronghorns mâles pèsent entre 41 et 64 kg, les femelles entre 34 et 48 kg[4]
Ce mammifère possède un pelage à dominante fauve. Cette couleur lui permet de se camoufler dans les hautes herbes de la prairie américaine. Sa peau est couverte de poils drus cuivrés à brun-rouge sur le dessus. Le ventre, l'intérieur des membres, une zone rectangulaire entre les épaules et les hanches, l'écusson, le croissant sur la gorge et la croupe sont blancs[3]. Le cou porte une courte crinière noire et deux bandes blanches sur la partie inférieure. Le mâle a un masque noir et des taches noires sur le cou, ses cornes dépassent le bout de ses oreilles ; la femelle ne possède pas ces marques noires. La queue du pronghorn mesure entre 7,5 et 17,8 cm[3]. Les sabots pointus sont fendus et garnis de coussinets qui amortissent le choc des foulées atteignant huit mètres en pleine course. Les deux sexes ont des cornes noires qui tombent et repoussent chaque année.
Antilocapra americana se distingue des cervidés par ses cornes pointues et fourchues, de couleur noire. Elles sont constituées d'un cœur permanent en os recouvert d’une gaine de kératine qui tombe chaque année. Contrairement à celles des antilopes, ces cornes ne sont pas creuses. La longueur de celles-ci varie de 33 à 38 cm pour le mâle, et de 7 à 13 cm pour la femelle[5].
Les yeux saillants, particulièrement grands, d’un diamètre d’environ 36 millimètres et situés de chaque côté du crâne[6], donnent à l'antilope d'Amérique un champ de vision panoramique de 300 à 320 degrés. Cela permet à l'animal de détecter un mouvement à plusieurs kilomètres de distance et de voir arriver ses prédateurs. Le masque facial noir et les deux taches noires entre les oreille des mâles servent lors de la parade sexuelle et des démonstrations de supériorité hiérarchique. Les mâles ont neuf glandes sous-cutanées (deux sous les oreilles, deux à la croupe, quatre entre les orteils et une sous la queue) et les femelles six (deux à la croupe et quatre entre les orteils), produisant une odeur en cas de danger. L'odeur dégagée par les glandes subauriculaires sert à marquer le territoire pendant la parade sexuelle.
L'antilope d'Amérique est une espèce endémique de l'Amérique du Nord. À l'époque précolombienne, elle était très commune de la Saskatchewan au centre du Mexique. On estime à 35 millions le nombre d'individus avant l'arrivée des Blancs[3]. Aujourd'hui[Quand ?], 500 000 pronghorns vivent du sud de l’Alberta et de la Saskatchewan au Canada, à Villa Hidalgo en Basse-Californie et à l'ouest du Sonora au Mexique, en passant par l’ouest des États-Unis[3].
Cette espèce occupe des milieux naturels très variés : plaines, prairies, milieux semi-désertiques et en montagne, jusqu'à 3 300 mètres d'altitude[7],[3]. On la trouve plus rarement dans les bois clairs de conifères. Aux États-Unis, on la rencontre dans le Grand Bassin, les Montagnes Rocheuses, le plateau de la Columbia, le bassin du Wyoming et du Missouri, le plateau du Colorado, les Hautes et les Grandes Plaines[8].
En hiver, l'Antilocapra americana est grégaire et se déplace en larges troupeaux qui se séparent en été en groupes sexués plus restreints. En cas de danger, le pronghorn prévient ses congénères en hérissant la crinière située derrière le cou ainsi que les poils blancs de la croupe. Il peut également avertir d'une menace en sécrétant une odeur grâce à ses glandes[4].
Antilocapra americana est un animal véloce à la course extrêmement rapide. Elle atteint facilement les 74 km/h avec des pointes mesurées à 98 km/h[9] sur de courtes distances : c'est l'animal le plus rapide du continent américain[3],[7].
Certaines migrent sur des centaines de kilomètres à travers les Grandes Plaines, depuis le centre-nord du Montana jusque dans le sud de la Saskatchewan et de l'Alberta.
Le régime alimentaire d’Antilocapra americana varie selon la flore locale, mais les plantes le plus souvent consommées sont les plantes basses (autres que les graminées), les arbustes, les herbes et d'autres plantes (cactus, cultures, ...). Les plantes basses sont broutées du printemps à la fin de l'automne et sont essentielles pour la reproduction. Les arbustes, consommés toute l'année, le sont davantage en hiver. Les herbes sont consommées au printemps, et les autres aliments ont un intérêt variant selon les régions. La présence de feuilles charnues est un critère important décidant du choix de la nourriture, de l'emplacement et de l'attrait des territoires, de la durée des migrations et de la reproduction. Les dents d’Antilocapra americana sont conçues pour un broutement sélectif, et elles croissent continuellement pour compenser l'usure et fournir une surface unie pouvant broyer les végétaux les plus coriaces.
Les mâles comme les femelles atteignent la maturité sexuelle à 15 ou 16 mois[3]. Le Antilocapra americana est polygame et rassemble un harem de 2 à 15 femelles[5]. Seuls les mâles dominants s'accouplent, ce qui retarde ainsi le premier accouplement d'un mâle à l'âge de 5 ans. Les mâles marquent et défendent un territoire de début mars jusqu'à la fin du rut de 0,23 à 4,34 km2, les domaines vitaux des femelles pouvant atteindre 6,35 à 10,5 km2. Les jeunes mâles disposent de territoires périphériques, où le fourrage est moins bon. Le pronghorn est, avec le chevreuil, le seul ongulé territorial des latitudes septentrionales. Les femelles s'accouplent plus souvent avec les mâles des meilleurs territoires (c'est-à-dire, où le fourrage est de meilleure qualité et le sol plus riche), qui sont par conséquent dominants, et elles peuvent retourner toute leur vie s'accoupler sur le même territoire. 30 à 40 % des accouplements peuvent ainsi avoir lieu sur le ou les meilleurs territoires d'une région donnée. Un mâle dominant, qui peut conserver son domaine pendant 4 à 5 ans, peut ainsi être le géniteur de 15 à 30 % des faons nés une même année, et jusqu'à 50 % des mâles d'une classe d'âge donnée peuvent n'avoir jamais aucune descendance. Le rut se déroule de fin août à début octobre dans les régions du nord[3] et ne dure que deux à trois semaines.
La gestation dure en moyenne 252 jours[3]. Les jumeaux sont fréquents sur les bons territoires et les femelles ont de quatre à sept ovules. Ainsi, quatre œufs peuvent être fécondés en même temps, et dans ce cas, le sommet de l'embryon se trouvant dans les compartiments supérieurs de la matrice à deux poches se développe et perce la membrane fœtale de l'embryon inférieur, le tuant à l'intérieur de l'utérus. Généralement, la portée compte donc un à deux individus.
Les mères mettent bas entre avril et juin[5], et les faons nouveau-nés peuvent peser jusqu'à 3,9 kg sur les bons territoires. Dès l'âge de deux jours, le faon court plus vite qu'un cheval, mais il manque d'endurance pour suivre une harde en pleine vitesse. Il se cache donc dans le feuillage pendant 21 à 26 jours. Les faons ne sont en contact avec leur mère que 20 à 25 minutes par jour pour l'allaitement, pour éviter d'attirer l'attention des prédateurs. Plus vieux, les faons se réunissent en petits groupes, les contacts avec leurs mères sont toujours très limités. L'allaitement et le grooming continuent jusqu'à 4 à 5 mois, mais le développement du comportement agressif des mâles peut causer leur sevrage 2 à 3 semaines plus tôt que chez les femelles. Le jeune garde un pelage gris jusqu'à l'âge de trois mois environ.
Il y avait peut-être entre 30 et 60 millions d’individus au début du XIXe siècle en Amérique du Nord[5]. Ce nombre est tombé à moins de 15 000 en 1915[5] et l'espèce était alors presque entièrement éteinte. Les autorités instaurèrent un moratoire sur la chasse dans les années 1940. Des fonds furent collectés pour la préservation de l’espèce par des taxes prélevées sur les armes à feu et sur les articles de sport[5].
Actuellement, on compte environ 500 000 individus au Canada et aux États-Unis[3],[7]. L'espèce est en revanche menacée au Mexique avec environ 1 200 animaux[3]. Plus de 4 000 pronghorns ont été transplantés au Nouveau-Mexique entre 1936 et 1957[3]
Antilocapra americana est aujourd'hui victime de collisions avec les automobiles et de la disparition de son habitat naturel. Il peut vivre 11 années en captivité[3]. Le zoo de Winnipeg a eu un mâle de 15 ans[7].
Les principaux prédateurs d’Antilocapra americana sont les coyotes[5] qui s'attaquent aux faons.
Phylogénie des familles des Cétartiodactyles actuels (Cétacés non développés), d'après Price et al., 2005[10] et Spaulding et al., 2009[11]:
Cetartiodactyla TylopodaCamelidae (Chameaux, lamas…)
Suidae (Porcins)
Tayassuidae (Pécaris)
Cetacea (Baleines, dauphins ...)
Hippopotamidae (Hippopotames)
Tragulidae (Chevrotains)
Antilocapridae (Antilocapres)
Giraffidae (Girafes, okapi...)
Bovidae (Bovins, Caprins et antilopes)
Cervidae (Cerfs, rennes...)
Moschidae (Cerfs porte-musc)
Le pronghorn[12] est aussi appelé Prongbuck, Pronghorned Antelope et American Antelope en anglais. Ce nom a été donné par les Européens qui la comparaient, à tort, à une antilope africaine[7],[13], dont il n’est pourtant pas directement parent.
Les fossiles nous indiquent que Antilocapra americana remonte à l'époque du Miocène[3]. Antilocapra est le seul représentant d'une famille qui comptait au moins 12 espèces au Pléistocène[4] Aujourd'hui, le pronghorn est le seul représentant de la famille des Antilocapridae.
Les différences entre les sous-espèces sont difficiles à établir à cause des mélanges et des transplantations opérées par les Hommes. On établit généralement cinq sous-espèces connues[14] :
Antilocapra americana est la seule espèce du genre Antilocapra, et également la seule représentante actuelle de la famille des antilocapridés (Antilocapridae). Elle est appelée Antilope d'Amérique ou Antilocapre en français, ou encore pronghorn (dénomination anglaise parfois utilisée en français). Ce mammifère vit dans la partie ouest de l'Amérique du Nord, dans des milieux très divers.
Ainmhí a bhfuil cosúlacht ghinearálta an antalóip air agus atá dúchasach do Mheiriceá Thuaidh. Donn éadrom le súile feiceálacha. Na hadharca ar an mbaineannach gearr, na hadharca ar an bhfireannach le beangán chun tosaigh is na bioranna cuartha ar gcúl. Caitear ciseal seachtrach na n-adharc gach bliain. Tagann sé gar do rudaí a bhíonn faoi ghluaisne, fiú ainmhithe creiche. Áitríonn sé tailte féaraigh.
O antílope americano[1] (Antilocapra americana), chamado pronghorn en inglés e berrendo polos castelán falantes americanos, é unha especie de mamífero artiodáctilo, a única actual da familia dos antilocápridos e do xénero Antilocapra.[2]
Aínda que hoxe e o único representante da familia, esta contaba até principios do plistoceno con numerosas especies. Co paso do tempo, todas se extinguiron por diversas causas, deixando ao antílope americano actual como único vestixio da súa presenza.
Pese a que se lles chama antílopes americanos non son verdadeiros antílopes.[3] Presenta un marcado dimorfismo sexual, sendo os machos maiores, cun peso de 45 a 60 kg, mentres que as femias pesan entre os 35 e os 45 kg.
Difire do resto dos ruminantes de cornos ocos por ter estoxos córneos caducos. Ambos sexos posúen cornos curvos e dirixidos cara a atrás que mudan cada ano, como os cervos, pero nunca se desprenden da base ósea que hai baixo a superficie córnea.
Estes cornos son máis grandes (de 12,5 a 45 cm) e están ramificados nos machos, mentres que nas femias son curtos (de 2,5 a 15 cm) e sen ramificacións. Tanto as femias como os machos presentan unha coroa de pelo na base dos cornos e unha crina de cor negra.
A lonxitude da cabeza e tronco é de 1,30 a 1,50 m, a altura na cruz de 70 a 80 cm, a cola mide uns 10 cm, e as orellas uns 15 cm.
A forma do corpo recorda aos antílopes xa que, ao igual que eles, teñen o lombo a maior altura que os ombros, e as súas extremidades son delgadas e longas.
A pelaxe é de cor leonada ou pedrés (de dúas cores) no lombo (de onde provén o seu nome en castelán berrendo), aínda que en inverno escurécese lixeiramente. A cor aclárase nas partes inferiores do corpo até volverse branca na cara, garganta, ventre, patas e glúteos. Un elemento característico desta especie é a presenza dunha gran mancha branca ao redor da rexión caudal, que está presente en machos, femias e crías; a pelaxe nesta zona encréspase cando o animal nota algún perigo, o que serve de advertencia a outros membros do grupo. Na parte do pescozo sobresaen dúas bandas brancas localizadas unha á altura da gorxa e outra debaixo dela. Hai bandas de pelo escuro no nariz, na fronte, nas meixelas, nas partes posteriores do pescozo e da cola. As patas teñen catro dedos, aínda que camiñan sobre dous.
O antílope americano é propio de América do Norte, encontrándose desde o sur do Canadá, a través do oeste dos Estados Unidos, até o norte de México (Baixa California, Sonora, Chihuahua e Hidalgo).[4]
O hábitat característico destes animais son os espazos abertos, como chairas herbáceas e semidesertos.
Aliméntanse durante gran parte do día de herbas, arbustos, musgos e, en ocasións, incluso de cactos. Móvense en grandes grupos, á veces en mandas de centos de animais, especialmente no verán. Os integrantes destas mandas son sempre femias coas súas crías e machos novos. Os machos adultos e os vellos adoitan seren solitarios ou viviren en pequenos grupos, aínda que ás veces poden formar tamén rabaños formados unicamente por individuos machos. En outono os machos en idade reprodutora compiten entre si trucando testa con testa co fin de gañar o dereito a reproducirse.
Ao contrario que en moitos outros ungulados, os machos non abandonan as mandas de femias tras a época de celo, senón que permanecen unidos a elas durante todo o inverno seguinte.
Tras 230 días de xestación, as femias paren unha cría (se é o seu primeiro parto) ou dúas no mes de xuño. Estas crías son de cor gris e pesan de 2 a 4 kg. Poucas semanas despois van adquirindo a tonalidade dos adultos.
Inmediatamente despois do parto, as femias separan ás súas crías e escóndenas entre o mato, aínda que se manteñen vixiantes nas zonas próximas e acoden regularmente para amamentalas.
Actualmente os antílopes americanos non contan con auténticos depredadores. Porén, son os mamíferos más rápidos de América do Norte,[5] podendo correr a 65 km/h durante varios quilómetros, saltando de 3 até case 6 m.[3] A súa velocidade máxima rexistrada é de 98 km/h.[Cómpre referencia]
Debido a iso, é raro que morran presas doutros animais. Os lobos, coiotes, linces vermellos (Lynx rufus), pumas e aguias reais poden matar crías de poucos días, pero incluso isto non é algo común, pois os pequenos antílopes poden pasar horas agochados entre a vexetación e sen realizar ningún movemento que poida delatalos. Ás poucas semanas de nacer deixan de esconderse e seguen á súa nai, sendo xa máis rápidos que os seus potenciais cazadores.
A posíbel causa da velocidade do antílope americano é que até hai á penas 20 milenios si tiña un depredador do que preocuparse. Nas praderías americanas habitaban daquela felinos similares ao guepardo de Asia e África, pertencentes ao xénero extinto Miracinonyx, que probabelmente alcanzaban velocidades similares a este (105 km/h en treitos curtos). A velocidade e a resistencia á carreira desenvolvéronse co fin de escapar deles e, cando os guepardos americanos se extinguiron a finais da última glaciación, os antílopes simplemente seguiron sendo igual de veloces que até entón.
Debido a esta ausencia de depredadores, os antílopes americanos multiplicáronse sen problemas durante o holoceno, e á chegada dos primeiros europeos formaban mandas de millóns de exemplares nas chairas de Canadá, Estados Unidos e México. Isto cambiou coa chamada "conquista do Oeste". Ao igual que os bisontes, os antílopes americanos foron obxecto dunha brutal matanza a mans dos colonos durante todo o século XIX, morrendo miles cada ano.
A principios dos anos 1800 había probabelmente da orde de máis de 35 millóns de animais. En 1924 críase que a especie estaba cerca da extinción, con só uns 20.000 exemplares. Antes de que a especie diminuíra máis ditáronse leis para protexela a ela e máis ao seu hábitat, polo que o seu número aumentou en dez veces entre 1924 e 1964.[6]
A finais do século XX o número de espécimes estimábase nuns 700.000. A especie xeralmente estaba declinando en México, aínda que era máis estábel no resto da súa área de distribución; porén, o seu número variaba dependendo da severidade das secas e dos invernos.[7] Estimábase que existían menos de 300 individuos de berrendo sonorense en Estados Unidos e de 200 a 500 individuos en Sonora, México.[8]
Na actualidade a poboación do antílope americano alcanza case os 3 millóns de animais,[Cómpre referencia] sendo especialmente abundantes nas zonas protexidas de Wyoming e Colorado. Nalgunhas zonas a caza volveu a ser permitida co fin de controlar o exceso de poboación.
A UICN cualifica a situación da especie como LC (pouco preocupante).[4]
Recoñécense as seguintes subespecies:[2]
Cladograma dos Certartiodactyla[9] existentes segundo Spaulding et al. 2009.[10]
CetartiodactylaTylopoda - Camelidae (camelos, llamas, guanaco e vicuña)
Suina (porcos e pecarís)Tayassuidae (pecarís)
Suidae (porcos)
RuminantiaTragulidae (cervos rato)
PecoraAntilocapridae
Giraffidae (xirafa e ocapi)
Moschidae (cervos almiscreiros)
Cervidae (cervos)
Bovidae (touros, cabras, ovellas e antílopes)
Hippopotamidae (hipopótamos)
Cetacea (cetáceos)
O antílope americano (Antilocapra americana), chamado pronghorn en inglés e berrendo polos castelán falantes americanos, é unha especie de mamífero artiodáctilo, a única actual da familia dos antilocápridos e do xénero Antilocapra.
Aínda que hoxe e o único representante da familia, esta contaba até principios do plistoceno con numerosas especies. Co paso do tempo, todas se extinguiron por diversas causas, deixando ao antílope americano actual como único vestixio da súa presenza.
Vitoroga antilopa (Antilocapra americana) ili viloroga antilopa, a ponekada i rašljoroga antilopa je jedina postojeća vrsta porodice Antilocapridae,[1] jedne od dvije porodice sisavaca koje žive samo u Sjevernoj Americi (druga porodica je Aplodontidae).
Vitoroge antilope nastanjuju otvorene travnate oblasti i šipražje zapadnih Sjedinjenih Američkih Država i Kanade, kao i neke dijelove Meksika.
Vitoroga antilopa je duga, od glave do repa, 140 cm. U ramenima je visoka 87 cm, a teži 47-70 kg. Ženke su inače za 10-25% manje od mužjaka. Ova antilopa je poznata po svojoj brzini, budući da može postići brzinu od 86 km/h, a može održavati brzinu od 70 km/h preko 6,4 km. Imaju zdepasto tijelo i duge i vitke noge. Papci su dugi, špicasti, razdvojeni i zaštićeni kako bi mogli podnijeti udarce koraka jer vitoroga antilopa može skočiti do 8 metara u daljinu kada trči. Oba spola imaju rogove, koji su kod mužjaka dugi oko 43 cm s naprijed okrenutim vrhovima. Ženke imaju kratke rogove, duge oko 4,2 cm. Pomoću svojih velikih očiju, zaštićenih crnim trepavicama, mogu vidjeti sve u vidnom polju od 360°.
Gornji dio tijela je smeđe-žute boje, dok su stomak i unutrašnja strana udova, četverokutni dio između ramena i kukova, linije ne vratu i stražnjica bijeli. Mužjaci imaju crno lice i dvije crne šare ispod ušiju, koje koriste pri udvaranju i pokazivanju dominantnosti. Miris je vrlo važan za vitoroge antilope i zato mužjaci imaju 9 mirisnih žlijezda, a ženke 6. Mužjaci označavaju teritoriju žlijezdama na glavi.[1]
Zubi su im prilagođeni za hranjenje raznim prerijskim biljkama, šipražjem, travama, ali i kaktusima i usjevima. Zubi stalno rastu zbog trošenja.
Oba spola su zrela sa 16 mjeseci. Ženke stvaraju 4-7 jajašaca, ali najviše 4 oplođena mogu da stanu u maternicu. Tjeranje traje dva do tri tjedna, a bremenitost 252 dana. Mladunci se kote krajem svibnja ili početkom lipnja i na rođenju su teška 3,4 do 3,9 kg. Mladunci su u stanju prestići konja sa dva dana starosti, ali nemaju snage za duga putovanja sa ostatkom krda, pa ostaju skriveni u travi dok ne napune 21-26 dana. Ženke brinu o mladima 4-5 mjeseci, s tim da se mužjaci odbijaju od dojenja 2-3 tjedna prije ženki. Vitoroge antilope žive oko 10 godina, a u zatočeništvu i 15.[2][3][4] Odrasli mužjaci ne brinu o svojim potomcima.
Vitoroga antilopa (Antilocapra americana) ili viloroga antilopa, a ponekada i rašljoroga antilopa je jedina postojeća vrsta porodice Antilocapridae, jedne od dvije porodice sisavaca koje žive samo u Sjevernoj Americi (druga porodica je Aplodontidae).
L'antilocapra (Antilocapra americana (Ord, 1815)) è l'unica specie vivente della famiglia Antilocapridae Gray, 1866 e del genere Antilocapra Ord, 1818. È l'animale terrestre più veloce dopo il ghepardo: può avvicinarsi ai 90 Km/h,[2] e, nell'ipotesi in cui potessero incontrarsi, verrebbe superata dal felino solo sulle brevi distanze. Nonostante il nome, Antilocapra americana è filogeneticamente piuttosto lontana dalle antilopi, dalle capre e dalle specie della famiglia Bovidae e più vicina ai Giraffidae.
Le corna sono composte di una sostanza lanosa che cresce attorno ad una base ossea; la parte più esterna viene ricambiata annualmente. I maschi pesano dai 45 ai 60 kg, le femmine dai 35 ai 45 kg. Le corna dopo il ricambio pesano dai 2 ai 4 kg. Gli adulti sono di colore bruno, con natiche e ventre bianchi e due strisce bianche sul collo. Una criniera corta e scura cresce attorno al collo. L'antilocapra maschio ha corna ramificate di circa 30 centimetri. Le corna nella femmina sono lunghe circa la metà e non hanno ramificazioni.
Formula dentaria Arcata superiore 3 3 0 0 0 0 3 3 3 3 1 3 3 1 3 3 Arcata inferiore Totale: 32 1.Incisivi; 2.Canini; 3.Premolari; 4.Molari;Il lupo, il coyote e la lince rossa sono i principali predatori dell'antilocapra. Si hanno anche segnalazioni di piccoli e esemplari adulti predati dall'aquila reale
L'antilocapra fu resa nota al mondo scientifico grazie alla spedizione di Lewis e Clark (1804-1806) che la scoprirono nell'odierno Dakota del Sud. L'area di diffusione di questo animale va dalle zone meridionali delle province canadesi del Saskatchewan e dell'Alberta fino a Sonora e alla Bassa California messicana. Vivono anche sulle Montagne Rocciose e si spingono ad est fino al fiume Missouri. Tuttavia, in molte zone sono ormai estinte. Nel Messico e in Arizona è diffusa la sottospecie Antilocapra americana sonoriensis.
L'habitat principale delle antilocapre è la prateria; tuttavia, è possibile trovarle anche nelle zone più povere di vegetazione e persino nei deserti. Si nutrono di cactus, erba, arbusti e germogli.
Nell'interazione della specie con le infrastrutture antropiche è stata notata una predilezione per l'uso dei sovrappassi autostradali rispetto ai sottopassi [3].
Dal 1908, la caccia ha decimato la popolazione delle antilocapre fino a circa 20.000 esemplari. La tutela dell'habitat naturale e restrizioni sulla caccia hanno determinato una ripresa demografica (fino ai due o tre milioni di esemplari attuali).
Frohlich, Jan & Kubickova, Svatava & Musilova, Petra & Cernohorska, Halina & Muskova, Helena & Vodicka, Roman & Rubes, Jiri. (2017). Karyotype relationships among selected deer species and cattle revealed by bovine FISH probes. PLOS ONE. 12. e0187559. 10.1371/journal.pone.0187559.
L'antilocapra (Antilocapra americana (Ord, 1815)) è l'unica specie vivente della famiglia Antilocapridae Gray, 1866 e del genere Antilocapra Ord, 1818. È l'animale terrestre più veloce dopo il ghepardo: può avvicinarsi ai 90 Km/h, e, nell'ipotesi in cui potessero incontrarsi, verrebbe superata dal felino solo sulle brevi distanze. Nonostante il nome, Antilocapra americana è filogeneticamente piuttosto lontana dalle antilopi, dalle capre e dalle specie della famiglia Bovidae e più vicina ai Giraffidae.
Šakiaragis, šakiaragė antilopė (Antilocapra americana) – porakanopių (Artiodactyla) žinduolių, monotipinės šakiaraginių (Antilocapridae) šeimos rūšis. Endeminė Šiaurės Amerikos rūšis, sutinkama vidurinėje ir vakarinėje žemyno dalyje.
Tai stirnos dydžio, labai greitas (kartais net iki 98 km/h[1]) žinduolis. Nors sunku tiksliai nustatyti maksimalų šakiaragių greitį ir jis skiriasi tarp individų, manoma, jog tai antras pagal greitį sausumos gyvūnas, kurį lenkia tik gepardas[2]. Šakiaragiai didelį greitį išlaiko ilgiau, nei gepardai, bet prastai šokinėja. Kadangi šiuo metu šakiaragiai greičiu stipriai lenkia visus Šiaurės Amerikos plėšrūnus, manoma, jog jie adaptavosi prie jau išnykusių plėšrūnų, pvz., amerikinių gepardų[3].
Kailis nuo raudonai iki gelsvai rudos spalvos, kūno apačia balta. Patinų ragai ypatingos sandaros: ant poros kaulinių galvos išaugų yra raginės makštys, kaip ir dykaraginių, tačiau jos dvišakos. Be to, kasmet numetamos ir užauginamos naujos. Patinų ragai yra ilgesni už ausis, su į priekį nukreipta atšaka per vidurį; patelių ragai trumpesni už ausis. Žiemą susiburia į didžiules bandas. Augalėdžiai.
Dvidešimto amžiaus pradžioje tai buvo sparčiai nykstanti rūšis, tačiau dabar jų skaičius pakilęs iki maždaug 700 tūkstančių[4].
Šakiaragis, šakiaragė antilopė (Antilocapra americana) – porakanopių (Artiodactyla) žinduolių, monotipinės šakiaraginių (Antilocapridae) šeimos rūšis. Endeminė Šiaurės Amerikos rūšis, sutinkama vidurinėje ir vakarinėje žemyno dalyje.
Tai stirnos dydžio, labai greitas (kartais net iki 98 km/h) žinduolis. Nors sunku tiksliai nustatyti maksimalų šakiaragių greitį ir jis skiriasi tarp individų, manoma, jog tai antras pagal greitį sausumos gyvūnas, kurį lenkia tik gepardas. Šakiaragiai didelį greitį išlaiko ilgiau, nei gepardai, bet prastai šokinėja. Kadangi šiuo metu šakiaragiai greičiu stipriai lenkia visus Šiaurės Amerikos plėšrūnus, manoma, jog jie adaptavosi prie jau išnykusių plėšrūnų, pvz., amerikinių gepardų.
Kailis nuo raudonai iki gelsvai rudos spalvos, kūno apačia balta. Patinų ragai ypatingos sandaros: ant poros kaulinių galvos išaugų yra raginės makštys, kaip ir dykaraginių, tačiau jos dvišakos. Be to, kasmet numetamos ir užauginamos naujos. Patinų ragai yra ilgesni už ausis, su į priekį nukreipta atšaka per vidurį; patelių ragai trumpesni už ausis. Žiemą susiburia į didžiules bandas. Augalėdžiai.
Dvidešimto amžiaus pradžioje tai buvo sparčiai nykstanti rūšis, tačiau dabar jų skaičius pakilęs iki maždaug 700 tūkstančių.
De gaffelbok (Antilocapra americana), ook wel gaffelantilope of pronghorn genoemd, is een evenhoevig zoogdier, afkomstig van de grasvlakten en woestijnen van Noord-Amerika. De gaffelbok is de laatste nog levende vertegenwoordiger van de familie der gaffelantilopen (Antilocapridae). Hij is niet nauw verwant aan de veel grotere groep der antilopen uit Afrika, Arabië en Azië, die tot de holhoornigen (Bovidae) behoren. De gaffelbok is op de jachtluipaard na het snelste landdier op aarde.
De gaffelbok is een middelgroot hoefdier met een ronde romp, kleine staart en lange, slanke ledematen. De poten zijn aangepast aan rennen: lang, dun en gespierd. Hij heeft twee tenen, de derde en de vierde. De bijhoeven ontbreken. De snuit is lang en smal. Het zichtvermogen is zeer goed ontwikkeld. De grote ogen (diameter van 5 cm) staan hoog en diep in de schedel. Omdat zij opzij van de kop staan, bestrijken zij een gezichtsveld van 360°. Om de ogen te beschermen tegen zonlicht, heeft de gaffelbok lange, dichte wimpers. Ook reuk en gehoor zijn goed ontwikkeld. De oren zijn lang en spits. Het vrouwtje heeft vier tepels.
De inwendige organen zijn aangepast op het hardlopen. Hart en longen zijn goed ontwikkeld. Ook de lever en nieren zijn relatief groot. De lever slaat grote hoeveelheden glycogeen op, wat kan worden omgezet in glucose. Ook kan de grote lever stoffen afvoeren als seleen en alkaloïden, waar sommige prairieplanten rijk aan zijn en voor veel andere dieren giftig zijn. De nieren zijn vergroot om het lichaamsvocht efficiënt te hergebruiken, een aanpassing aan het leven in drogere streken.
De gaffelbok heeft 32 tanden en kiezen. De bovenkaak bevat geen snijtanden. De snijtanden in de onderkaak staan naast de hoektanden en hebben dezelfde vorm. De kiezen en valse kiezen groeien door, een aanpassing aan het eten van taaie plantendelen. De tandformule is 0.0.3.3 / 3.1.3.3 {displaystyle 0.0.3.3/3.1.3.3} 
De vacht bestaat uit een wollige ondervacht en lange, harde dekharen. De vachtkleur heeft een herkenbare, contrasterende kleurtekening. De rug en nek zijn roodbruin. De buik is vuilwit tot helder wit, en aan de stuit ligt een witte spiegel. Op de hals lopen twee horizontale, halvemaanvormige witte vlekken. In het gelaat heeft hij een patroon van witte en bruine vlekken. Mannetjes bezitten daarnaast een donkere, bijna zwarte keelvlek en snuitpunt en een donkere klier achter de wangen, vlak onder de oren.
In de huid zitten vele spiertjes, waarmee hij de vachtharen elke kant kan opzetten. Bij hitte zet hij de haren uit, zodat hij kan afkoelen, bij kou legt hij de haren plat tegen lichaam. De witte haren in de spiegel kunnen eveneens worden opgezet, waardoor deze groter lijkt. Dit heeft een functie in de communicatie.
Beide geslachten hebben hoorns. Deze zijn ver naar voren ingeplant, boven de oogkas. Zijn hoorns verschillen van de hoorns van de holhoornigen doordat ze gevorkt zijn en bedekt met een schede van keratine, die van tijd tot tijd afgeworpen wordt. Dit is enigszins vergelijkbaar met het afwerpen van het gewei bij hertachtigen. Bij het mannetje stopt de hoornschede vanaf augustus met groeien. In oktober, vrij snel na de bronst, groeit er een nieuwe schede onder de oude, waardoor de laatste wordt afgeworpen. Vrouwtjes hebben een meer onregelmatige cyclus.
De hoorns van het mannetje zijn 24–30 cm groot en steken boven de oorschelpen uit. Zij hebben de gaffelvorm waaraan het dier zijn naam dankt: de hoorn heeft twee punten, een scherpe punt die omhoog steekt en aan de top naar achteren buigt en een stevigere zijtak die naar voren steekt. De hoorns bereiken zijn maximumgrootte na drie tot vier jaar. De hoorns van het vrouwtje zijn kleiner, tot 5 cm grote knobbeltjes of een eenvoudig onvertakte hoorn tot 7 cm, maar nooit langer dan het oor.
De gaffelbok heeft een kop-romplengte van 130 tot 140 cm en een staartlengte van 9,7 tot 10,5 cm. De schofthoogte bedraagt 86 tot 87,5 cm en het lichaamsgewicht 30 tot 80 kg.[2] Seksueel dimorfisme in lichaamsverhoudingen is klein: vrouwtjes zijn 10% kleiner dan mannetjes.
De gaffelbok leeft voornamelijk in de graslanden, woestijnen en uitlopers van gebergten van Noord-Amerika. Hij heeft een voorkeur voor open gebieden zoals prairies met een grote verscheidenheid aan wilde bloemen, en vermijdt gebieden waarin het zicht belemmerd wordt. De gaffelbokken profiteerden vroeger van de enorme kuddes bizons die over de prairies leefden: de bizons aten veel van het gras weg, waardoor mozaïeken van grassen en vele soorten wilde bloemen achterbleven.
Vroeger kwamen de gaffelbokken over de gehele Great Plains voor. Doordat het merendeel van de prairies nu in cultuur is genomen als landbouwgebied, zijn de populaties uitgeweken naar die gebieden die te hoog of te droog zijn voor landbouw. Het verspreidingsgebied omvat tegenwoordig het westelijke deel van de Great Plains, van Zuid-Canada (het zuiden van de Canadese provincies Alberta en Saskatchewan), zuidwaarts tot Noord- en Centraal-Mexico.[2] Hij leeft hier van zeeniveau tot een hoogte van 3350 m. In 1959 werden enkele dieren uitgezet op het Hawaïaanse eiland Lanai, maar is hier bijna uitgestorven.[1]
De gaffelbok is de gehele dag door actief. De dag en de nacht bestaan uit perioden van foerageren en rusten. Het herkauwen vindt plaats tijdens de rustperiode. Slaap is beperkt tot zeer korte perioden van minder dan tien minuten.
Tijdens het foerageren legt een kudde ongeveer 6 km per dag af. De gaffelbok eet voornamelijk kruiden en wilde bloemen, met een voorkeur voor planten met veel eiwitten, aangevuld met grassen in het vroege voorjaar. In de herfst en winter eten ze vaker de bladeren van struiken als woestijnbijvoet (Artemisia tridentata). In sommige gebieden eet hij ook cactussen. Het is een zeer kieskeurige herbivoor, die soms slechts één blaadje van een plant eten. Gaffelbokken kunnen overleven in gebieden zonder een vaste waterbron, maar als de mogelijkheid er is, drinken ze eenmaal daags, vooral in een warme zomer.
Na de bronstperiode, begin oktober, vormen zij grote gemengde kuddes van tot wel duizend dieren. Veel populaties trekken 's winters naar warmere, sneeuwvrije gebieden. Kuddes in Montana leggen jaarlijks 160 km af, van kuddes in Wyoming en South Dakota is bekend dat zij bij zeer streng weer 320 km kunnen afleggen.
In het voorjaar splitsen de kuddes zich op in kleinere groepen. Vrouwtjes en hun kalveren verzamelen zich in kleine kuddes. Mannetjes van drie jaar en ouder leiden in deze periode een solitair bestaan. Zij keren dan terug naar hun vaste territorium, dat een oppervlak heeft van 23 tot 434 ha. In de zomer trekken de kudden vrouwtjes naar deze territoria om zich aan te sluiten bij harems. Zo'n harem bestaat uit gemiddeld 23 dieren: een mannetje, vrouwtjes en haar kalveren. Het mannetje markeert zijn territorium door op een opvallende plaats de grond schoon te stampen, hierop te urineren en vervolgens zich in het midden te ontlasten. Ook brengt hij geurmarkeringen aan. Jonge mannetjes van één tot drie jaar oud zijn nog te jong om een eigen plaats te veroveren en leven apart in vrijgezellengroepen, waar ook oudere mannetjes die uit hun territorium verjaagd zijn zich bij aansluiten.
Als een mannetje het territorium van een ander mannetje betreedt, zal deze hem proberen weg te jagen. Hij staart hem eerst aan, om vervolgens al schreeuwend hem te achtervolgen. Dit eindigt zelden in gevechten, meestal zal het andere mannetje ervandoor gaan. Mocht dit niet werken, zal er een gevecht optreden, waarbij de mannetjes tegen elkaar aan botsen. Deze gevechten kunnen er hevig aan toe gaan. In een derde van de gevallen eindigt een gevecht in ernstige verwondingen of de dood.
Dieren leven niet in vaste kuddes, maar wisselen geregeld van groep. Binnen de kudde lijken de dieren geen onderlinge sociale banden te hebben, op de band tussen vrouwtjes en hun jongen na. Ondanks de losse structuur van de groepen heerst binnen de kudde wel een hiërarchie. Dominante dieren houden zich voornamelijk op in de kern van de groep, onderdanige dieren aan de rand. Vrouwtjes verwerven hun sociale rang al als zij een maand oud zijn en behouden deze voor de rest van hun leven.
Vrouwtjes zijn bronstig van mid-september tot begin oktober. In het zuiden begint de bronst eerder, vanaf eind juli. Het vrouwtje kiest het mannetje uit. Twee weken voor de bronst gaat het vrouwtje verscheidene mannetjes langs. Bij ieder mannetje blijft ze één à twee dagen voordat ze haar keuze maakt. Het mannetje benadert het vrouwtje door zijdelings met zijn kop te zwaaien en hinnikende, kreunende en smakkende geluiden te maken. Bij het zwaaien toont het mannetje de grote zwarte klieren onder zijn oren. Het vrouwtje bepaalt uiteindelijk of hij met haar mag paren. Als het vrouwtje nog niet tot copulatie bereid is, maakt zij dit duidelijk door een stap opzij te zetten. Meerdere vrouwtjes kiezen vaak dezelfde mannetjes, waardoor slechts een klein gedeelte van de mannetjes aan paren toekomt.
De gaffelbok heeft een lange, zeer variabele draagtijd van gemiddeld 248 dagen. In drogere jaren is de dracht langer. In het voorjaar trekt het vrouwtje zich terug uit de groep om te werpen. Zij krijgt vrijwel altijd twee jongen per worp, die bij de geboorte ongeveer 3,5 kg wegen. De daaropvolgende tijd groeien ze gemiddeld 245 gram per dag. De eerste tien dagen verbergen de kalveren zich op een aparte schuilplaats. De jongen liggen zelden verder dan 100 m uit elkaar. Iedere keer als het vrouwtje terugkeert om te zogen, leidt zij de kalveren naar een nieuwe plaats. Als een jong wordt gegrepen door een roofdier, leidt het vrouwtje haar overgebleven jong naar een verder gelegen plaats, tot 1 km ver, en zal zij die plaats in toekomstige jaren vermijden als schuilplaats. Na drie tot vier weken verzamelen de vrouwtjes en kalveren zich in groepen. De kalveren worden eind augustus gespeend, als zij zo'n 12 weken oud zijn.
Over het algemeen zijn vrouwtjes zestien maanden oud als zij voor het eerst bronstig worden, een enkele keer al als zij vier maanden oud zijn. Zij worden daarna ieder jaar opnieuw bronstig. Mannetjes zijn geslachtsrijp na 16 weken, maar zijn meestal pas in hun derde jaar groot genoeg om succesvol met andere mannetjes te kunnen concurreren en met vrouwtjes te kunnen paren.
De gaffelbok communiceert over het algemeen met zijn lichaamshouding. Een onderdanig dier draait zich weg of loopt weg van een dominant dier. Agressie uit de gaffelbok door gericht naar zijn opponent te staren, hem met de kop lichtelijk omhoog getild te benaderen en tegen hem aan te botsen.
Over het algemeen is hij stil, maar hij kent enkele geluiden. Het meest herkenbaar is de snuivende hijg die het mannetje voornamelijk in de bronsttijd slaakt om zijn harem te beschermen tegen een ander mannetje. Dit geluid bestaat uit een luide snuif, gevolgd door een korte pauze en eindigend in tien tot twintig puffen die elkaar gelijkmatig opvolgen en in volume afnemen. Tijdens de bronst slaakt het mannetje ook een luide brul als hij mannetjes of vrouwtjes achtervolgt. Tijdens de balts maakt hij hinnikende, kreunende en smakkende geluiden.
Een vrouwtje roept haar kalf met een zacht grommende blaat. Een kalf in gevaar slaakt een luide blaat, die zachter van geluid is dan dat van jonge witstaartherten en muildierherten.
Bij gevaar slaat de gaffelbok alarm met een snuivend geluid, stampt hij met een voorpoot en zet hij de lange haren van de witte spiegel op, waardoor deze groter lijkt. De spiegel bevat geurklieren, die bij het opzetten van de haren een geur verspreiden die lijkt op beboterde popcorn. De opgezette spiegel is een signaal voor gevaar en een herkenningsteken, zodat de groep bij elkaar kan blijven tijdens de vlucht.
Geursporen spelen eveneens een belangrijke rol tijdens de bronst. In de kaakhoek, vlak onder het oor, heeft het mannetje een grote zwarte geurklier. Deze klier toont het mannetje tijdens de balts aan het vrouwtje door zijn kop heen en weer te zwaaien. Ook zet hij een U-vormige strook haren op rond de middelste caudale klier, vlak voor de spiegel. Het mannetje markeert zijn woongebied door een plek schoon te stampen, hierop te urineren en vervolgens zich in het midden te ontlasten. Op dezelfde wijze camoufleert hij in de bronst de urine van de vrouwtjes in zijn harem.
Een belangrijke doodsoorzaak bij kalveren is predatie door coyotes en steenarenden. Dit geldt vooral voor de eerste 45 dagen, daarna hebben de kalveren een grootte bereikt waarbij zij veilig zijn voor coyotes. Voor volwassen dieren zijn extreme weersomstandigheden zoals strenge winters of langdurige droogte een belangrijke doodsoorzaak.
Gaffelbokken bereiken zelden een hoge leeftijd. Vrouwtjes worden zelden ouder dan twaalf of dertien jaar, mannetjes negen tot tien jaar.
De gaffelbok is het snelste hoefdier en een van de snelste zoogdieren ter wereld. In sprint haalt hij 100 km/u, maar hij is ook snel op de lange afstand. Hij kan 70 km/u volhouden over een afstand van meer dan 10 km. De paslengte wordt geschat op een afstand tot 8 meter, waarbij alle vier ledematen van de grond komen. Deze snelheden kan hij bereiken door aanpassingen als lange, slanke ledematen, een groot aantal mitochondriën in de spieren en een naar verhouding groot hart en longen, waardoor een grotere hoeveelheid zuurstof kan worden vervoerd door het lichaam. Omdat er gevaar is voor oververhitting, maken zij gebruik van warmtewisselaars in het bloedvatenstelsel: de retia mirabilia in de binnenste halsslagader en het buitenste oogbloedvat zijn groter dan die van grotere Noord-Amerikaanse herkauwers zoals de wapiti.
Geen huidig in Noord-Amerika levend roofdier behaalt deze snelheden. Gedacht wordt dat dit een aanpassing is aan roofdieren die in het Pleistoceen op de Noord-Amerikaanse prairies leefden, waaronder twee soorten Noord-Amerikaanse jachtluipaarden uit het geslacht Miracinonyx, die 50% groter waren dan de huidige jachtluipaard (Acinonyx jubatus).
De gaffelbok is de enige nog levende vertegenwoordiger van de gaffelantilopen (Antilocapridae), een familie van evenhoevige hoefdieren die ontstond in het midden-Mioceen en alleen bekend is van Noord-Amerika. De gaffelantilopen worden in twee onderfamilies verdeeld. De Merycodontinae waren kleine hoefdieren van 7 tot 30 kg die leefden van het midden- tot het laat-Mioceen. Tot de Merycodontinae behoren onder andere Merycodus, Ramoceros, met waaiervormige hoorns, en Paracosoryx, met lange, verticale hoorns die eindigden in een kleine vork. De tweede onderfamilie is de Antilocaprinae, grotere hoefdieren van 30 tot 80 kilogram die verschenen in het laat-Mioceen en waarschijnlijk van Merycodontinae afstammen. Soorten uit het Mioceen zijn onder andere Osbornoceros, met gedraaide hoorns, Ilingoceros, met spiraalsgewijs gedraaide, zeer lange hoorns, en Hexameryx, met drie paar hoorns. In het Pleistoceen leefden verscheidene soorten gaffelantilopen naast elkaar op de grasvlakten van Noord-Amerika, waaronder de huidige soort, Hayoceros, met het dubbele paar hoorns, en Capromeryx. Alleen de gaffelbok overleefde tot in het Holoceen.
Binnen de orde der evenhoevigen (Artiodactyla) worden de gaffelantilopen gerekend tot de herkauwers (Ruminantia). De verwantschap met andere families binnen deze familie is nog onduidelijk. Lang werden de gaffelantilopen gezien als de zustergroep van de holhoornigen (Bovidae), maar recent fylogenetisch onderzoek plaatst zij dichter bij de herten (Cervidae) of de giraffen (Giraffidae).
Vijf ondersoorten worden over het algemeen erkend.[3]
Van A.a. oregona en A.a. mexicana wordt de status van ondersoort echter niet ondersteund door genetisch bewijs. De twee zijn waarschijnlijk slechts geografische types van A.a. americana.
Op de Rode Lijst van de IUCN is de gaffelbok geclassificeerd als niet bedreigd.[1] Het is een algemene soort, waarvan de totale populatie op zevenhonderdduizend tot een miljoen individuen wordt geschat.[1] De helft van deze dieren leeft in Wyoming. De aantallen fluctueren door strenge winters en aanhoudende droogte, maar de gehele populatie wordt als stabiel beschouwd.
In de westelijke Verenigde Staten wordt er op de gaffelbok gejaagd. Hierdoor zijn gaffelbokken schuw en vluchten zij weg voor mensen en auto's. In gebieden waar er niet op gaffelbokken worden gejaagd, zoals in Yellowstone National Park of de National Bison Range Wildlife Refuge, zijn zij minder schuw en beter te benaderen.
De populatie is wel vele malen kleiner dan in het verleden. Geschat wordt dat aan het begin van de negentiende eeuw meer dan 35 miljoen dieren waren. Sindsdien daalden hun aantallen. Jacht was de belangrijkste oorzaak van de daling, gecombineerd met het uitsterven van de wolf in het verpreidingsgebied van de gaffelbok, waardoor de aantallen coyotes toenamen. Ook verlies van geschikt leefgebied aan landbouw, stedelijk gebied en mijnbouw, overbegrazing door vee en het verhinderen van oorspronkelijke trekroutes door hekken en andere barrières speelden een rol. Een hek van een meter is al gauw een barrière voor migrerende dieren. De gaffelbok kan springen, maar vermijdt dit liever, waarschijnlijk omdat hij een bot kan breken bij het landen. In 1924 waren nog maar dertien- tot twintigduizend dieren over. Door beschermingsmaatregelen stegen de aantallen weer. In 1964 was het aantal weer vertienvoudigd.
Alhoewel de soort in zijn geheel veilig is, zijn veel populaties versnipperd en klein. Vooral de Sonora-gaffelbok heeft hier onder te lijden. Omdat gaffelbokken voornamelijk leven in grote, aaneengesloten natuurgebieden, kan versnippering leiden tot een afname in gebruik van deze gebieden. Bovendien is voor deze populaties inteelt een mogelijke bedreiging. Stroperij is vooral voor de Mexicaanse populatie een probleem. Deze populatie neemt af en wordt beschermd onder Appendix 1 van CITES.[4] De ondersoort Antilocapra americana sonoriensis wordt als bedreigd beschouwd onder de Amerikaanse Endangered Species Act.[5] Op het dieptepunt waren er nog 21 dieren over. Tegenwoordig leven er minder dan driehonderd dieren in Arizona en twee- tot vijfhonderd dieren in Sonora. Van een andere ondersoort, A.a. peninsularis, zijn ongeveer tweehonderd dieren over.
Bronnen
Referenties en noten
De gaffelbok (Antilocapra americana), ook wel gaffelantilope of pronghorn genoemd, is een evenhoevig zoogdier, afkomstig van de grasvlakten en woestijnen van Noord-Amerika. De gaffelbok is de laatste nog levende vertegenwoordiger van de familie der gaffelantilopen (Antilocapridae). Hij is niet nauw verwant aan de veel grotere groep der antilopen uit Afrika, Arabië en Azië, die tot de holhoornigen (Bovidae) behoren. De gaffelbok is op de jachtluipaard na het snelste landdier op aarde.
Gaffelbukk (Antilocapra americana), også kalt prærieantilope eller gaffelantilope er eneste nålevende art i familien gaffelbukkfamilien (Antilocapridae) og slekten gaffelbukker (Antilocapra). Arten er endemisk for det vestre Nord-Amerika, fra Canada i nord til Mexico i sør. På tross av at de ofte kalles antiloper på engelsk er de ikke nære slekntinger av antilopene, men er søstergruppa til sjiraffdyrene, som nå utelukkende finnes i Afrika.
Gaffelbukken har tagget behorning som består av en permanent hornkjerne som er dekket av tynn hud. Kroppen er dekket med ullaktig underpels og stive og sprø dekkhår. Fargen er rødbrun over ryggen, nakken og brystet med nærmest hvit underside. På nakken har den er kort, sort man og to distinkte hvite stripemarkeringer. Halen og halepartiet er hvitt.
Hannen, som kalles bukk, har sort maske og sorte flekker på siden av nakken. Begge kjønn bærer horn, men hunnens tagger blir sjelden lenger enn ørene (ca. 12 cm). Hannens horn blir omkring 25 cm. Hannene blir også ca. 10 prosent større enn hunnene i snitt. Vekten hos voksne dyr ligger på ca. 36-70 kg, avhengig av kjønn. Skulderhøyden varierer normalt mellom 81 og 104 cm, mens kroppslengden gjerne blir ca. 100-150 cm. I tillegg kommer halen med ca. 7,5-18 cm.
Gaffelbukken er utbredt i høyder fra 0-3 353 moh i det vestre Nord-Amerika, fra det sørlige Alberta og Saskatchewan i Canada i nord til Baja California, det vestre Sonora og Hidalgo i Mexico i sør.
Prærieantiloper, som er polygame, er svært hurtige dyr som kan nå en toppfart på opp mot 86 km/t[2], noe som gjør den til det hurtigste av alle pattedyr i den nye verden. Hannene danner territorier som de forsvarer ovenfor andre hanner. Hunner og kalver danner mindre flokker som ferdes fritt på tvers av hannenes territorium. Om vinteren kan prærieantilopene danne store, løse flokker på opp mot 1 000 dyr, men disse løser seg opp igjen på vårparten.
Dyra er døgnaktive, men det er kjent at aktivitetsnivået er høyest like etter solnedgang og like før soloppgang.
I nord opptrer paringstiden, som varer i ca. tre uker, i perioden fra midt i september til tidlig i oktober. Sør i utbredelsesområdet begynner paringstiden tidligere, gjerne fra slutten av juli. Hunnen går drektig i ca. 252 dager og føder normalt 1-2 kalver, som normalt veier ca. 2-4 kg. Kalvene har grå pels til de blir omkring tre måneder gamle. De begynner å spise planteføde fra de er ca. tre uker gamle, selv om kalvene dier moren mye lenger.
Det er beskrevet flere underarter av prærieantilope[3], men taksonomien er ifølge U.S. Fish and Wildlife Service med flere uklar.[4]
Noen regner også A.a. anteflexa som en egen underart, men dette er svært omdiskutert. Den og A.a. oregona skiller seg fra hverandre kun gjennom at sistnevnte bare har sort farge på nesen. De fleste regner derfor disse to som varianter av samme underart. Det er imidlertid et uavklart spøsmål om A.a. oregona kan regnes som en egen underart selv eller må regnes som en variant av A.a. americana. Thomas E. Lee med flere fant at den ikke var distinkt nok.[5]
Midt på 1800-tallet fantes det trolig flere millioner prærieantiloper i Nord-Amerika, men på 1920-tallet estimerte amerikanske myndigheter at den knapt var omkring 20 000 tilbake i USA. I 1985 ble totalbestanden anslått til omkring 800 000 dyr, hvorav et overveldende flertall tilhørte underarten A.a. americana.
Nå er tre av underartene truet av utryddelse. Av A.a. sonoriensis (sonoraantilope) regner man at det færre enn 500 tilbake. Disse er forholdsvis jevnt fordelt mellom USA og Mexico. Av A.a. peninsularis (vizcaínoantilope) er det trolig færre enn 150 igjen, alle i Vizcaíno-ørkenen i Baja California. I tillegg kommer et lite antall som lever i fangenskap. Av A.a. mexicana (Chihuahuaantilope) skytes det omkring 500-600 bukker årlig. Totalbestanden er imidlertid usikker, men tendensen er synkende. For denne underarten frykter man også at det er en viss genflyt mellom bestandene i USA og Mexico.
Gaffelbukk (Antilocapra americana), også kalt prærieantilope eller gaffelantilope er eneste nålevende art i familien gaffelbukkfamilien (Antilocapridae) og slekten gaffelbukker (Antilocapra). Arten er endemisk for det vestre Nord-Amerika, fra Canada i nord til Mexico i sør. På tross av at de ofte kalles antiloper på engelsk er de ikke nære slekntinger av antilopene, men er søstergruppa til sjiraffdyrene, som nå utelukkende finnes i Afrika.
Widłoróg amerykański[3], dawniej: widłoróg lub antylopa widłoroga[4] (Antilocapra americana) – gatunek ssaka kopytnego, jedyny żyjący przedstawiciel rodzaju widłoróg (Antilocapra) i rodziny widłorogowatych zamieszkujący Amerykę Północną. Widłorogi amerykańskie są najszybszymi zwierzętami Ameryki Północnej – na krótkich dystansach (do 1,5 km) osiągają do 95 km/h[5] wykonując przy tym skoki o długości do 6 metrów.
Widłorogi amerykańskie występują od południowych części prowincji Alberta i Saskatchewan w Kanadzie przez zachodnie Stany Zjednoczone do zachodniej Sonory w Meksyku. Preferują rozległe, lekko pofałdowane tereny, porośnięte roślinnością typową dla prerii – trawą, której wysokość nie przekracza połowy metra. Część populacji występuje na obszarach, gdzie rosną także krzewy. Widłoróg amerykański żyje w dosyć suchym klimacie, gdzie roczna suma opadów jest niewystarczająca do wegetacji drzew.
Spotykane są od poziomu morza do 3353 m n.p.m. Stado zajmuje zazwyczaj obszar o powierzchni od 440 do 1200 ha.
Wysokość w kłębie: 81-104 cm[6]
Długość ciała: 100-157 cm[6]
Długość rogów: samica – do 12 cm, samiec – do 25 cm[6]
Masa ciała: samiec 45-60, samica 35-45 kg
Długość życia: w niewoli – do 12 lat[6]
Tułów jest pokryty gęstą, rudobrązową sierścią, a na głowie, zadzie, brzuchu, dwóch półksiężycach na szyi i wewnętrznych stronach kończyn – białą. Położone po bokach głowy oczy pozwalają na obserwowanie okolicy podczas posiłku, a długie, szczupłe kończyny umożliwiają szybką ucieczkę. Krótki ogon schowany jest w białej kępce włosów na zadzie nazywanej lustrem. Rogi zbudowane są z substancji budową przypominającej sierść, która rośnie na kostnym rdzeniu. Wierzchnia warstwa jest zrzucana raz do roku, po okresie godowym. Budowa ciała przystosowana do długotrwałego biegu. Mały żołądek i wątroba magazynująca duże ilości glikogenu sprawiają, że antylopa przystosowała się do dużego wysiłku. Zwierzęta te mogą przebyć kilka kilometrów, szybko biegnąc i wykonując długie skoki. Przeciętna prędkość w biegu wynosi 40 km/h, na krótkich dystansach nawet do 95 km/h.
Widłorogi amerykańskie są zwierzętami stadnymi, aktywnymi zarówno w dzień, jak i w nocy. Zimą antylopy zamieszkujące okolice górskie schodzą na niżej położone tereny, gdzie łatwiej znaleźć pokarm. Wiosną stada rozpraszają się, a latem samce zbierają wokół siebie samice z młodymi. Te, którym nie udało się znaleźć własnej grupy, tworzą osobne gromady. Jesienią widłorogi amerykańskie znowu łączą się w stada.
Rodzaj zjadanego pokarmu jest zależny od pory roku i obszaru zajmowanego przez poszczególne stada. Latem jedzą rośliny zielne, oraz trawy, jesienią jagody, zimą podskubują gałązki krzewów i grzebią w śniegu w poszukiwaniu pożywienia. Co kilka dni przemieszczają się w inne miejsce, żeby żerować. Jeśli nie mają dostępu do zbiorników słodkiej wody odżywiają się zaopatrzonymi w nią roślinami.
Samice widłorogów amerykańskich osiągają dojrzałość płciową w wieku 10-12, a samce 15-16 miesięcy. Latem samce zbierają wokół siebie grupy samic i znakują swój rewir moczem, odchodami i wydzieliną gruczołów skórnych, pozostawionymi na pniach, krzewach i brzegach strumieni. Kiedy obcy osobnik wkroczy na obszar należący do innego widłoroga amerykańskiego, odbywają się rytualne walki, a przegrany odchodzi.
Ciąża trwa od 250 do 252 dni. Na czas porodu samice oddalają się od stada. Na świat przychodzi 1, czasem 2 bardzo dobrze rozwinięte młode, ważące 2 – 4 kg, pokryte szarym, jedwabistym futrem. Trzy tygodnie spędzają ukryte w trawie. Matki karmią je mlekiem i za każdym razem starannie je wylizują oraz zjadają ich odchody. Dzięki takiej toalecie małe antylopy nie wydzielają zapachu, który mógłby zwabić drapieżniki. Po 3 tygodniach młode zaczynają skubać trawę, ale nadal pobierają mleko matki. Młode potrafią dobrze biegać, 4-dniowy widłoróg amerykański biegnie szybciej niż dorosły człowiek. Matki przyprowadzają młode do stada i od tego momentu opieka samic ogranicza się do karmienia.
W pierwszej połowie XX wieku z powodu przekształcania prerii w tereny rolnicze populacja widłorogów wyraźnie się zmniejszyła. W tym czasie zakazano polowania na te antylopy i zaczęto ponownie osiedlać je na dawniej zajmowanych terenach, w wyniku czego wielu farmerów musiało opuścić swoje gospodarstwa. Symbolem ochrony środowiska w Kanadzie i Stanach Zjednoczonych stała się antylopa widłoroga.
Widłoróg amerykański, dawniej: widłoróg lub antylopa widłoroga (Antilocapra americana) – gatunek ssaka kopytnego, jedyny żyjący przedstawiciel rodzaju widłoróg (Antilocapra) i rodziny widłorogowatych zamieszkujący Amerykę Północną. Widłorogi amerykańskie są najszybszymi zwierzętami Ameryki Północnej – na krótkich dystansach (do 1,5 km) osiągają do 95 km/h wykonując przy tym skoki o długości do 6 metrów.
O antilocapra (Antilocapra americana), conhecido coloquialmente na América do Norte como antílope-americano (embora não seja um antílope) é um ungulado artiodáctilo girafoide nativo da América do Norte e um dos animais mais rápidos do mundo, com velocidades de corrida que atingem até 80 km/h. A espécie é a única do seu género e a única extante da família Antilocapridae e inclui quatro subespécies, com distribuições geográficas diferentes.[1][2] É o parente vivo mais próximo dos girafídeos.
O antilocapra macho pesa entre 45 e 60 kg, sendo a fêmea menor com 35 a 45 kg. Os machos possuem um par de cornos com cerca de 30 cm de comprimento, estruturados em torno de uma base óssea e forrados com uma substância pilosa que é renovada anualmente. Algumas fêmeas têm também cornos, sempre menores e mais rectilíneos que os dos machos. A coloração é de cor castanha dourada, com barriga, zona da cauda e queixo brancos. O antilocapra tem também duas riscas horizontais de cor branca na garganta. Os machos apresentam uma crina castanha e uma mascara mais escura em torno dos olhos. As crias de cor acinzentada nascem com 2 a 4 kg de peso.
O antilocapra é um animal herbívoro de hábitos gregários, que vive em manadas numerosas. A sua distribuição geográfica estende-se desde o sul dos estados de Saskatchewan e Alberta, no Canadá, à Baixa Califórnia e deserto de Sonora no México. O limite Este é demarcado pelo rio Missouri.
Os predadores naturais do antilocapra, especialmente dos juvenis, são lobos, coiotes e linces. Com uma velocidade máxima registada de 98 km/h, o antilocapra é o segundo animal mais rápido do mundo, ultrapassado apenas pela chita que vive na savana africana. Esta rapidez evoluíu como resposta à presença de predadores extremamente rápidos, não os actuais, mas a chita americana, extinta do Plistocénico.
Desde a sua descoberta que os antilocapras foram caçados em grande número pelos pioneiros americanos. A caça excessiva quase levou a espécie à extinção e em 1908 restavam apenas cerca de 20,000 exemplares. Subsequente protecção legal e banimento da caça possibilitou a recuperação e hoje em dia existem entre 2 a 3 milhões de antilocapras. A abundância da espécie obriga mesmo a caça organizada para efeitos de controlo de população.
O antilocapra (Antilocapra americana), conhecido coloquialmente na América do Norte como antílope-americano (embora não seja um antílope) é um ungulado artiodáctilo girafoide nativo da América do Norte e um dos animais mais rápidos do mundo, com velocidades de corrida que atingem até 80 km/h. A espécie é a única do seu género e a única extante da família Antilocapridae e inclui quatro subespécies, com distribuições geográficas diferentes. É o parente vivo mais próximo dos girafídeos.
A. a. americana
A. a. mexicana
A. a. oregona
A. a. peninsularis
A. a. sonoriensis
Vilorog (znanstveno ime Antilocapra americana), tudi antilopska koza[3] ali ameriška antilopa, je gamsu podoben sodoprsti kopitar iz osrednjega in tudi zahodnega dela Severne Amerike. Gre za endemično ameriško vrsto in hkrati edino vrsto iz družine vilorogov.
Čeprav se vrsta v angleščini in posledično tudi drugih jezikih pogovorno pogosto označuje kot antilopa, pa gre le za sorodnika iz istega reda, zato je izraz antilopa v strokovnem smislu zavajajoč. V slovanskih jezikih se vrsta imenuje po značilnih razcepljenih rogovih, ki spominjajo na vile oz. razsoho za sušenje sena (češko vidloroh americký, hrvaško viloroga, vitoroga ali rašljoroga antilopa, poljsko widłoróg, rusko vilorog, srbsko račvoroga antilopa, ukrajinsko vilorig).
Vilorog (znanstveno ime Antilocapra americana), tudi antilopska koza ali ameriška antilopa, je gamsu podoben sodoprsti kopitar iz osrednjega in tudi zahodnega dela Severne Amerike. Gre za endemično ameriško vrsto in hkrati edino vrsto iz družine vilorogov.
Gaffelantilop eller gaffelbock (Antilocapra americana)[2] är ett i Nordamerika förekommande partåigt hovdjur. Djuret är den enda nu levande arten i familjen gaffelantiloper (Antilocapridae).
Djurets horn består av benkvicke, beklädd med hornslida och den återfinns hos båda kön. Men dessa hornslidor inneslutar ett ovanligt mycket större antal hår än vad som är fallet hos slidhornsdjur. Denna hylsa fälls gång på gång under djurets liv. Gaffelantilopen är rostfärgad. Men på sidorna, på buken och kring svansen samt vid några ställen på huvudet och halsen är den vit. Hornen är svarta. Den fullvuxne hannen är upp till 150 centimeter lång och den genomsnittliga längden för båda kön är 145 centimeter.[3] Över bogarna är den 80 och över landen 96 centimeter hög. Honan är märkbart mindre än hannen. Men med undantag av att hornen är mindre eller stundom saknas är den lika hannen.
Tandformeln är I 0/3 C 0/1 P 3/3 M 3/3, framtänder och hörntänder finns alltså bara i undre käken.[3]
Gaffelantilopens utbredningsområde ligger mellan Saskatchewan och mellersta Mexiko, Missouri och Stilla havet. Den uppehåller sig i huvudsak på slätterna och undviker skogar och bergstrakter. Ändå hittade man individer i regioner 3 300 meter över havet.[3]
År 1959 infördes arten på Hawaii men den hade svårt att etablera sig och beståndet där är nästan utdött.[3]
Den uppträder i flockar eller hjordar av hundratals djur. Gaffelantilopernas föda utgörs huvudsakligen av det korta, saftiga präriegräset, men även av andra växter. Under vintern lider djuren ofta stor nöd, när djup snö täcker marken, och då omkommer inte sällan många individer. De älskar saltvatten eller rent salt och väljer ofta till vistelseort ställen, där sådant står dem till buds. Intet på prärierna förekommande djur överträffar gaffelantilopen i snabbhet, och den utmärker sig för vaksamhet och skygghet. Djurets hastighet uppgår till cirka 65 km/h över sträckor av omkring 5 kilometer längd (maximum vid sprint 98 km/h).[3]
Parningstiden infaller i september och mellan bockarna utkämpas strider. I maj eller juni föder honan vanligen två enfärgade ungar som växer ganska fort.
Gaffelantilopens naturliga fiender utgörs främst av vargen och prärievargen. På grund av den höga hastigheten som vuxna gaffelantiloper uppnår jagar den förstnämnda vanligen bara ungdjur, gamla och sjuka individer. Gaffelantilopen försvarar sig genom att slå med sina bakre hovar mot angriparen, detta beteende hjälper främst mot prärievargen. Andra naturliga fiender är rödlo, puma och kungsörn.[3]
Arten systematiska position var länge oklar. Trots att den tidig klassificerades som en självständig familj fanns fram till 1980-talet många zoologer som räknade gaffelantilopen som underfamilj till slidhornsdjuren. Efter undersökningar av djurets DNA blev det känt att arten utgör systergruppen till hjortdjuren.
Utdöda medlemmar av familjen Antilocapridae hade tidigare en större utbredning i Nordamerika. Det äldsta kända släktet, Paracosoryx, levde under miocen och hade långa gaffelhorn. Senare uppkom Ramoceros, med horn i form av små skyfflar, samt Meryceros, Cosoryx och Osbornoceros som var ganska lika dagens gaffelantilop. Under pliocen levde Plioceros som hade en kort hals och breda men korta horn. Den nu levande arten uppkom under pleistocen och samtidig levde några mera kompakta släktingar som Tetrameryx och Capromeryx.
För gaffelantilopen skiljs mellan fyra och sex underarter:[4]
Ytterligare en underart, Antilocapra americana anteflexa, anses vanligen som likadant med Antilocapra americana americana.
Det vetenskapliga släktnamnet är sammansatt av det grekiska ordet antholops (kreatur med eleganta horn) och det latinska ordet capra (get av honkön). Artepitet syftar på Amerika.[5]
Indianerna jagade djuret främst för köttets skull med de använde även huden för skjortor och de vita delar till handskar. Gaffelantilopen spelade en betydande roll i ursprungsbefolkningens vardag då den var ett av de vanligaste jaktbyten, omkring år 1800 fanns ungefär 40 miljoner individer fördelade över prärien. Hos de västliga shoshonerna fanns till exempel en ritual där deltagarna under ledningen av gruppens schaman spelade gaffelantilopjakt. Liksom jakten på bisonoxen hade jakten på gaffelantilopen religiösa dimensioner.
Den vanligaste jaktmetoden hos de västliga shoshonerna var ett jaktlag som med hjälp av eld drev flocken mot ett annat jaktlag eller mot ett hinder, till exempel en flod eller en hage som byggdes innan. De nordliga shoshonerna skapade däremot ett kamouflage av gaffelantilopskin och smyglade sig fram till flocken. Till och med när indianerna fick hästar var gaffelantilopjakten en utmaning på grund av gaffelantilopens högre hastighet jämförd med hästens hastighet.
Trots indianernas jakt var gaffelantilopen inte hotad i beståndet.
För Nordamerikas nybyggare var gaffelantilopen länge okänd. Arten upptäcktes och beskrevs först i samband med Lewis och Clarks expedition (1804–1806). Vid denna tid var Nordamerikas gräsmarker befolkade med särskild många bisonoxar och gaffelantiloper.
När de vita män spred sig över prärien hade gaffelantilopen ett liknande öde som bisonoxen. I början dödas de för köttets och pälsens skull men senare blev jakten endast ett nöje där bara hornen togs med som trofé. Efter järnvägens uppkomst sköts tusentals gaffelantiloper direkt från tåget och kadavren blev kvar på bägge sidor av järnvägslinjen. Därför minskade populationen fram till 1920-talet till omkring 13 000 individer.[6] Efteråt inrättades skyddsåtgärder och beståndet återhämtade sig. Numera uppskattas beståndet med 500 000 till 1 miljon individer och hela arten klassas åter som livskraftig.[1]
För tre underarter i sydvästra delen av utbredningsområdet är situationen fortfarande allvarlig. Underarterna är A. a. sonoriensis i Arizona, A. a. peninsularis på Baja California och A. a. mexicana i övriga delar av Mexiko. A. a. sonoriensis skyddas sedan 1967 enligt U.S. Endangered Species Act och 1998 påbörjade United States Fish and Wildlife Service ett program som ska återinföra underarten i andra delar av det ursprungliga levnadsområde.[1] De mexikanska underarterna listas av CITES i appendix I. För alla delstater i västra USA gäller ett förbud att skjuta gaffelantilopen eller att fånga den i fällor.[1]
Gaffelantilop eller gaffelbock (Antilocapra americana) är ett i Nordamerika förekommande partåigt hovdjur. Djuret är den enda nu levande arten i familjen gaffelantiloper (Antilocapridae).
Amerika antilobu (Antilocapra americana), Kuzey Amerika'da yaşayan bir gevişgetiren çift toynaklı türü. Çatalboynuzlu antilop ya da Çatalboynuzlu hayvan olarak da bilinir.
Dış görünüşü ile bir antilobu andırmasına rağmen Asya'da ve Afrika'da yaşayan antiloplar ile akrabalığı yoktur. Bu yüzden yalnız başına Antilocapridae adlı ayrı bir familyaya konulur. Amerika antilobu bu eski familyanın günümüzde yaşayan son temsilcisi olarak kalmıştır.
Amerika antilobu bir ceylan büyüklüğündedir. 150 cm uzunluğa (artı 8–15 cm kuyruk), 90 cm boya ve 50–70 kg ağırlığa ulaşır. Üst kısımları sarı ile kızıl kahverengi arası değişir, karın kısımları beyaz olur. Beyaz tüylerini dikerek, bu şekilde birbirlerini tehlikeye karşı uyarmak için işaret verebilirler. Erkeklerin boynuzları kulaklarının iki katına, 25 cm uzunluğa varır. Dişilerin neredeyse hiç boynuzları olmaz. Eğer boynuzları olursa da asla kulakların uzunluğunu aşmaz. Her boynuzun ucu çatallanır, bir ucu köküne yakın bir yerden dışarıya doğru ve diğeri daha yukarıda içeriye yönelir. Boynuzlar her sene yenilenir.
Amerika antilopları çok uzun atlayabilmeleri ile de dikkati çekerler. Tek bir sıçrama ile 6 metre ilerleyebilirler.
Amerika antilobu bir zamanlar bütün Kuzey Amerika'da, hatta çöl ve yarı çöllerinde ve Meksika'nın kuzeybatısına kadar uzanan geniş bir coğrafyaya yaygındı. Kayalık Dağları'nda bazen hatta 3500 m yüksekliğe kadar çıkarlar, ama genelde düz bölgelerde yaşarlar.
Amerika antilobunun sınıflandırılması uzun süre tam olarak aydınlatılamamıştır. Daha en başlardan ayrı bir familyaya konulmuş olsa da, 1960'lara kadar hala sırf boynuzlugillerin bir alt familyası olduğunu savunan zoologlar olmuştur. Sonunda DNA analizleri sayesinde geyikgillerin bir kardeş grubu oldukları kanıtlanmıştır.
Geçmişte Amerika antilobugiller familyasının Kuzey Amerika'da birçok türleri olmuştur. Familyanın tanılan en eski üyesi erken Miyosen çağında ortaya çıkan, uzun çatallı boynuzlu Paracosoryx cinsi olmuştur. Sonradan ortaya çıkan Ramoceros cinsinde boynuzlar çengel olmuş ve çatallıdır. Daha geç zamanlarda ortaya çıkan Meryceros ve Cosoryx cinsleri bugünkü Amerika antilobuna daha çok benzemişlerdir. Pliyosen çağında birçok Plioceros cinsine ait kısa boyunlu, kısa ve kalın boynuzlu türler ortaya çıkmıştır. Pleistosen çağında daha çevik yapılı, buzul çağına ayak uydurmuş Tetrameryx ve Capromeryx cinsleri ortaya çıkmıştır. Bu iki cins familyanın (Stockoceratini) adlı ayrı bir kolunu oluşturur. Buzul çağının sonunda bütün bu türlerin soyu tükenmiş, ve Pleistosen çağında da çoktan var olmuş olan Amerika antilobu familyanın tek temsilci olarak hayatta kalmıştır.
Bilimcilerin farklı görüşlerine göre 4 ya da 6 alt türü kabul edilir. Bu 4 türün statüleri hala tartışılmaktadır:
Bazı kaynaklarda Antilocapra americana anteflexa ve Antilocapra americana oregona alt türleri isimlerine rastlanılır. Ancak bu isimler sırf Antilocapra americana americana alt türü için kullanılan diğer isimlerdir.
Amerika antilobu (Antilocapra americana), Kuzey Amerika'da yaşayan bir gevişgetiren çift toynaklı türü. Çatalboynuzlu antilop ya da Çatalboynuzlu hayvan olarak da bilinir.
Dış görünüşü ile bir antilobu andırmasına rağmen Asya'da ve Afrika'da yaşayan antiloplar ile akrabalığı yoktur. Bu yüzden yalnız başına Antilocapridae adlı ayrı bir familyaya konulur. Amerika antilobu bu eski familyanın günümüzde yaşayan son temsilcisi olarak kalmıştır.
Рід вилоріг Antilocapra Ord, 1818 представлений одним видом — вилоріг Antilocapra americana Ord, 1815. Було названо п'ять підвидів, але загально визнано тільки три[3]:
Однак виконані аналізи мітохондріальної ДНК, починаючи з ранніх 1990-х років, підтримують ідею існування одного виду з широкими межами, а не окремих підвидів[3].
Цей оленеподібний ссавець має рудувато-коричневу спину та білі черево та зад. Як продовження білого крупу, вся нижня частина тіла від плечей до стегон теж біла та має форму великої прямокутної плями з обидвох сторін. У нього дві широкі білі смуги впоперек рудувато-коричневої шиї та коротка чорна грива. У самців широка чорна смуга йде від очей вниз по морді до чорного носа та чорні плями на нижній щелепі. На нижній частині голови та під вухами теж білі плями. Білі губи та підборіддя контрастують із чорними носом, ротом, очима та блискучими чорними рогами. Забарвлення вилорога специфічне та має певне призначення. Рудувато-коричневі, чорні та білі кольори допомагають тваринам зливатися з природним оточенням. Сонорський вилоріг є меншим та світліше забарвленим серед інших підвидів: пристосування до посушливого пустельного оточення. Усі вилороги мають дуже короткий, майже непомітний, хвіст, вуха пропорційні до їхнього тіла та розвинуті сальні залози. Довге пухнасте підшерстя вкрите грубою ламкою шерстю. Роги вилорогів складаються з постійної кістяної основи покритої виростами рогового чохла, що скидаються щороку. Роги самців, виростаючи повністю, досягають 28–50 см, вигнуті назад та злегка до голови, з зубцем на середині рога — схожі на вила, за що тварини й отримали свою назву. Самиці не мають такого чорного забарвлення та роги в них менш вилоподібні та не довші від їхніх вух: зрідка більші 8–10 см. Голова з видовженою мордою та великими очима.
Вилороги мають гострий зір, що важливо для тварини, яка живе на відкритих рівнинах. Вони можуть помітити об'єкт на відстані приблизно 3.2 км[4]. Очі вилорогів сильно випнуті, надзвичайно великі (приблизно 3 см у діаметрі) та розміщені високо ззаду по обидві сторони голови. Це надає їм великий кут огляду, майже 360 градусів, не повертаючи голови.
Будова тіла вилорогів надзвичайно сприяє швидкому бігу цих тварин, завдяки чому вилороги є найшвидшими ссавцями Північної Америки. Вилоріг друга найшвидша тварина суші після африканського гепарда, однак може підтримувати досить високу швидкість від 59 до 65 км/год на відміну від гепарда[4]. Є гіпотеза, що вилоріг розвинув таку здатність, щоб утікати від американського гепарда[5]. Вилоріг має дуже довгі ноги, він пересувається на кінчиках копит; ноги та м'язи пристосовані до швидкого бігу на довгі дистанції. У нього великі трахея, легені та серце, що дозволяє отримувати достатню кількість кисню, необхідного під час тривалого бігу. Серце вилорога удвічі більше за серце домашньої вівці, хоча обидві тварини мають однакову вагу. Крім цього, вилороги використовують свою збільшену систему органів дихання для дихання ротом, заковтуючи повітря. Це допомагає збільшувати витривалість, і не є ознакою втоми тварини. Пристосування вилорогів до швидкого бігу розвинулося за давніх часів в американських преріях, тому що давні вилороги мали втекти від доісторичних гепардів та вовків. Жоден сучасний хижак не може наздогнати та впіймати здорового дорослого вилорога.
Самиці переважно мають чотири молочні залози, проте зафіксовані випадки шести залоз у деяких тварин.
Висота та довжина тіла коливаються в межах 1000—1500 мм, довжина хвоста 75–178 мм та висота холки 810—1040 мм. Самці в середньому на 10 % більші від самиць. Маса 36–70 кг.
Вилоріг поширений на території від південних частин канадських провінцій Альберти та Саскачеван, через захід США до Ідальго, Баха-Каліфорнії та західної Сонори, Мексика; від річки Міссурі до Скелястих гір[3].
Вилоріг проживає на відкритих рівнинах американських прерій у трав'янистих, полинових та низькочагарникових місцевостях та пустелях; на висоті до 3353 м над рівнем моря[3].
Вилороги полігамні тварини. У північних регіонах поширення тварин розмноження відбувається під час тритижневого періоду з середини вересня до перших днів жовтня. У південних регіонах поширення розмноження починається раніше, наприкінці липня. Під час парування самиці запліднюють від 4 до 7 яйцеклітин. Переважно під час першої вагітності самиці народжують одного малюка й до двох малюків при наступних вагітностях. Період вагітності триває 252 дні. Вага новонароджених оленят 2–4 кг. Малюки мають сіре забарвлення та несхожі на дорослих, проте вже у тримісячному віці досягають забарвлення дорослих тварин. У віці чотирьох днів оленятко може випереджати людину в бігу. В три тижні їсть деякі рослини та все ще ссе густе та поживне молоко матері. Роги починають рости у віці шести місяців. Максимальної величини (250 мм) у самців роги досягають у 2–3 роки. Статевого дозрівання тварини досягають у віці 5 (самці) та 16 місяців (самиці). Самці не спаровуються поки їм не виповниться три роки. Самці не допомагають у виховуванні дитинчат[4].
Максимальна тривалість життя вилорогів становить 16 років у дикій природі, хоча вони рідко живуть довше 9 років. Поширені причини смерті: хижаки, жорстка зима з глибоким снігом, брак води, полювання або автомобільні зіткнення. У неволі зафіксовано максимальну тривалість життя 11 років[4].
Вилоріг може досягнути швидкості 86 км/год, що робить його найшвидшим ссавцем Нового Світу. Тварини ведуть як денний, так і нічний спосіб життя. Найменш активні після заходу сонця та перед світанком[6]. Добові переміщення залежать від запасів корму: навесні та влітку до 1 км, восени та взимку до 10 км. Глибокі сніги змушують стада здійснювати переходи на 160 км.
У тварин добре розвинута соціальна організація. Восени та взимку вилороги збираються у великі стада до 1000 особин різного віку і статі, на чолі кожного з них стоїть вожак. З приходом весни стада починають розбиватися на менші розділені за статтю групи. У цей час самці віком від трьох років починають змагатися за територію. Їхні ділянки містять джерело питної води й часто обмежені природними перешкодами, які дозволяють самцям утримувати групи самиць всередині. Самці помічають свою територію запахом. Чужаків-самців зустрічає пильний погляд, що віщує агресію. Якщо прибулець продовжує порушувати межі ділянки, то виникає бійка (переважно безкровна). Молоді самиці формують групи, які мандрують поряд нічийними землями між ділянками. Території панівних самців фактично слугують притулком для самиць, бо ті захищають їх від молодих оленів, та усувають конкуренцію за найкращі джерела корму між самицями та молодими самцями. Після сезону парування рогові нарости скидаються, після чого ієрархічні відмінності стають нечіткими[6].
Серед вилорогів поширені декілька загальних голосових та візуальних сигналів: телята мекають при ізоляції від матері, самиця бурчить, коли шукає своїх телят, самиці ревуть під час поєдинків; самиці й самиці роздувають ніздрі, коли сердяться. Коли тварини бачать небезпеку, шерсть на білих сідницях випрямляється, що служить сигналом попередження для всього стада. Природними ворогами є койот, вовк, беркут, пума та рись[4].
Основу живлення складають різноманітні трави, листя, молоді пагони. Вилороги харчуються невеликими кількостями різноманітних рослин[4]. Взимку північні популяції значною мірою залежать від стебел, особливо, полину. Кактуси також поїдаються певною мірою, особливо в південних популяціях[3]. Раціон змінюється зі зміною регіону поширення тварин та залежить від місцевої флори. В літній дієті переважають трав'янисті дводольні види, а однодольні трави, як правило, з'їдаються лише тоді, коли відбувається їхнє нове зростання. Споживання води змінюється залежно від її вмісту в рослинності. Коли доступні ніжні листки, що мають вологість 75 % і більше, то, здається, вилорогам не потрібно пити воду. У сухі сезони або в сухих областях вилороги перебувають у межах від 5 до 6 км від води і можуть пити до 3 літрів на день. Взимку риють сніг передніми копитами, щоб дістатися до корму[4].
За оцінками, поголів'я вилорогів на початку XIX ст. становило 35 мільйонів голів. Вони були поширені на території від сходу штату Вашингтон та півдня штату Манітоба до півострова Баха Каліфорнія та північно-східної Мексики. У 1924 році приблизний підрахунок показав, що залишилося менше ніж 20 000 вилорогів. Таке зменшення чисельності тварин, швидше за все, було пов'язано з полюванням, у поєднанні з різким скороченням доступних місць проживання; і важкий випас худоби. Заходи щодо збереження та належна організація розповсюдження тварин збільшили цю кількість до нинішньої (2011) чисельності в приблизно 1 мільйон вилорогів (причому приблизно половина з них проживає у штаті Вайомінг). У Мексиці загрозою виду є браконьєрство та знищення природного середовища існування, яке проявляється в розвідці нафтових родовищ та відкритих видобутках корисних копалин. Чисельність вилорогів у Мексиці продовжує скорочуватись. За оцінками, є лише 300 особин сонорського вилорога у Сполучених Штатах і 200–500 — у Мексиці (U.S. Fish and Wildlife Service, 1998). Півострівних вилорогів приблизно 200 особин у та навколо центру розмноження у Баха-Каліфорнії. Загалом же чисельність вилорогів оцінюється в 1 мільйон[3]. Сонорський підвид A. a. sonoriensis та півострівний підвид A. a. peninsularis вилорогів занесені до червоних книг штатів США та Мексики, де вони мешкають. Цей вид населяє ряд великих та добре керованих природоохоронних територій, зокрема Єллоустонський національний парк[3].
Наукову назву Antilocapra americana можна перекласти як «американська антилопова коза». Родова назва Antilocapra складена із назв двох родів жуйних тварин: Antilope й Capra[7]. Видова назва вказує на частину світу, в якій проживають ці тварини.
Американська загальна назва «prong-horned antelope» або пізніше, скорочено «pronghorn» XIX ст. походження, означає «вилорога антилопа»[8]. У словнику Шарлеманя назву цього виду подано саме у вигляді «антилопа вилорога»[9].
Linh dương sừng nhánh (danh pháp khoa học: Antilocapra americana) là một loài động vật đặc hữu nội địa tây và trung bộ Bắc Mỹ. Nó là loài duy nhất còn tồn tại của họ Antilocapridae.[2] Trong thời kỳ Pleistocene, 12 loài Antilocapridae đã tồn tại ở Bắc Mỹ.[3]
Con đực trưởng thành dài 1,3-1,5m từ mũi đến đuôi, chiều cao 81–104 cm (32–41 in) tại vai và cân nặng 36–70 kg (79–154 lb). Con cái cùng chiều cao như con đực nhưng cân nặng 41–50 kg (90–110 lb). Chân có hai móng, không có móng huyền. Thân nhiệt là 38 °C (100 °F).[2][4][5][6]
Hiện nay loài này có không có kẻ thù thực sự. Chúng là những động vật có vú nhanh nhất ở Bắc Mỹ, có thể chạy 65 km/h trong vài km, nhảy cao từ 3 đến 6 mét, tốc độ tối đa được ghi nhận là 98 km/h.
Kết quả là, con trưởng thành hiếm khi trở thành con mồi của các loài động vật săn mồi khác. Chó sói, chó sói Bắc Mỹ, sư tử núi và đại bàng vàng có thể giết chết con non sau khi sinh một vài ngày, nhưng ngay cả điều này là không phổ biến, do khi linh dương nhỏ có thể bỏ ra hàng giờ cúi thấp giữa các thảm thực vật và không thực hiện bất kỳ chuyển động có thể khiến con mồi phát hiện. Một vài tuần sau khi sinh và tiếp tục dừng chân ẩn của mẹ mình, con non nhanh hơn so với các con thú săn.
Linh dương sừng nhánh (danh pháp khoa học: Antilocapra americana) là một loài động vật đặc hữu nội địa tây và trung bộ Bắc Mỹ. Nó là loài duy nhất còn tồn tại của họ Antilocapridae. Trong thời kỳ Pleistocene, 12 loài Antilocapridae đã tồn tại ở Bắc Mỹ.
Antilocapra americana
(Ord, 1815)
 Охранный статус
Охранный статус Вилорог[1] (лат. Antilocapra americana), вилорогая антилопа[2] — жвачное животное; самое древнее из копытных Северной Америки. Единственный современный представитель семейства вилороговых (Antilocapridae), которое в плиоцене и плейстоцене насчитывало не менее 70 видов.
Вилороги получили своё название из-за характерных крючковатых рогов, растущих и у самцов, и у самок, хотя у последних они тоньше и короче — лишь редко бывают длиннее ушей.
Красивое, стройное животное размером примерно с косулю: длина тела 100—130 см, высота в плечах 80—100 см; масса — 35—60 кг.
У самцов короткие, до 30 см, толстые рога, разветвлённые в виде вилки; у самок рога значительно меньше (5—7 см) и не раздвоены. Рога вилорога, как и рога полорогих (быков, коз, антилоп), представляют собой костные стержни, покрытые роговыми чехлами. Однако вилороги — единственные животные, у которых роговые чехлы ежегодно сбрасываются и отрастают вновь. Смена рогов происходит после сезона размножения и занимает более 4 месяцев. Таким образом, вилороги являются как бы промежуточной формой между оленями и полорогими.
Окраска вилорогов палево-коричневатая сверху и светлая снизу, с белым полулунным пятном на горле и белым «зеркалом». У самцов чёрный полуошейник на горле и чёрная «маска». Остевые волосы густые и слегка волнистые, на шее образуют торчащую гриву. Очень развиты у вилорогов пахучие железы (подглазничные, хвостовые и др.)
Вилороги хорошо приспособлены к быстрому движению благодаря толстой трахее, объемистым легким и большому сердцу, которое быстро гонит по всему телу обогащенную кислородом кровь. У самца вилорога сердце вдвое больше, чем у барана одного с ним веса. Хрящевые подушечки на передних ногах позволяют вилорогу легко бежать по самой каменистой почве.
Населяет степи Северной Америки от юго-западной Канады (Альберта, Саскачеван) до севера Мексики (Нижняя Калифорния, Сонора), и от реки Миссури до Скалистых гор.
Осенью и зимой вилороги собираются в сотенные стада с вожаком во главе. В зависимости от наличия корма и воды стада совершают миграции. Старые самцы чаще держатся поодиночке. Летом самки и холостые самцы живут небольшими кочующими группами; самцы старше 3 лет занимают участки от 0,23 до 4,34 км² площадью, которые охраняют от других самцов.
Интересна система сигнализации и оповещения в стаде вилорогов. Когда животное-сторож замечает опасность, оно взъерошивает волосы своего белого «зеркала», которое становится похожим на гигантскую хризантему. Другие животные немедленно повторяют этот сигнал, видимый невооружённым глазом более чем за 4 км, и тревога охватывает все стадо.
Группу вилорогов обычно ведет самка, а самец держится последним, чтобы подгонять отстающих. Это позволяет ещё издали отличить самцов от самок[3].
Кормом вилорогам служат травянистые растения, включая ядовитые, молодые побеги кустарников и кактусы. Пьют мало; при отсутствии источников в течение недель могут довольствоваться влагой, содержащейся в растениях. Такая особенность позволяет вилорогам далеко проникать в засушливые районы и пустыни. Пасутся круглосуточно.
Вилорог — второе в мире по скорости бега животное, уступает только гепарду. Может развивать скорость до 67 км/ч, совершая при этом прыжки 3,5—6 м длиной. Рекорд скорости — 88,5 км/ч. Однако такой темп животное выдерживает не более 5—6 км. Нормальная скорость бега вилорога — 48 км/ч.
Вилороги — полигамные животные. Период гона наступает в конце лета и длится около 2 недель. Между самцами в это время происходят жестокие драки. Самцы собирают гарем из 3—4 самок, иногда из 8—15. Беременность продолжается 230—240 дней. У 60 % самок родятся двойни. Новорождённый телёнок имеет массу 2—4 кг и серую окраску. В первые дни лежит, затаившись в траве, но уже через неделю хорошо бегает, через 3 недели начинает есть траву, а в возрасте 3 месяцев почти не отличим от взрослого животного.
Ещё в XIX веке вилорог встречался большими стадами и активно добывался ради мяса и шкуры, но к 1908 году его популяция с многомиллионной сократилась до 20 тысяч голов. В результате охраны и ограничения охоты поголовье было восстановлено до 2—3 млн особей. Основными хищниками являются волки, койоты и рыжие рыси. Длительность жизни вилорогов в природе 5—7, редко 10—12 лет.
2 подвида (A. a. peninsularis и A. a. sonoriensis) внесены в Красную книгу МСОП.
Всего 5 подвидов[4]:
Вилорог (лат. Antilocapra americana), вилорогая антилопа — жвачное животное; самое древнее из копытных Северной Америки. Единственный современный представитель семейства вилороговых (Antilocapridae), которое в плиоцене и плейстоцене насчитывало не менее 70 видов.

A. a. americana
A. a. mexicana
A. a. peninsularis
A. a. sonoriensis
叉角羚(Antilocapra americana)又名“美国羚羊”,仅有一科一属一种。分布于北美洲西部的开阔地带,北起加拿大南部,南到墨西哥北部。叉角羚奔跑速度极快(速度接近猎豹,耐久力远胜于猎豹),以高速耐力奔跑而闻名,长时间高速奔跑,一次跳跃可达6米。出生4天的羊羔就能比人跑得快。其最高速度可达每小时97公里,而且有着惊人的耐力,被誉为地球上最善于耐力奔跑的动物。善游泳。夏季组成小群活动,冬季则集结成上百只的大群。为寻找食物和水源,一年中常进行几次迁移。性机警,视觉敏锐,能看到数千米外的物体。遇险时,臀部的白色毛能立起,这是向同伴告警的一种特殊信号。叉角羚科动物曾经是史前北美食肉类动物北美猎豹、短面熊和恐狼、美洲拟狮、獵豹等动物的主要捕食对象。在美国洛杉矶著名的拉布雷沥青坑(Rancho La Brea)中发现了大量的叉角羚科动物化石。
叉角羚科动物起源于北美洲,是新北界的特有科。可能由北美早期牛科动物进化而来。 最早的叉角羚科化石为Paracosoryx prodromus, 出现于中新世早期(2100万年前)。 中新世中期的Merydocus属开始有分叉的角。 第四纪晚期和更新世是叉角羚科的繁盛时期,其成员的多样性远甚于现存物种。
叉角羚分布在从加拿大西Nevada省,经美国西部,一直到墨西哥的地区。白人到达美洲之前其分布遍及北美大陆。
叉角羚是新北界的标志物种之一。产于美国中西部地区。成体体长 1.32-1.49米,肩高 0.83-0.94米, 体重 50-75 公斤。背部为土黄色,腹部白色,颈部和臀部有显眼的白斑,鼻梁黑色,耳下常有黑斑至下颌。
叉角羚是一种形态多变的物种。其染色体的数目不固定,在一定范围内变化。时常有叉角羚个体长出额外的角、乳头和肋骨。一般有30%的雌羊终生不长角,还偶尔会长出形状异常的子宫。
一般情况下叉角羚雌雄均有角,雌羊的角比雄羊小、不分叉, 而公羊的角比较有特点,端部分叉,类似鹿科成员。叉角羚科的史前成员有结构更为复杂的角。叉角羚的角基为骨质(类似牛科),不会脱落,但由角质和部分被毛混合形成的角鞘则年年脱落(类似鹿科)。叉角羚长角的速度远快于牛科动物。
按比例来算,叉角羚的眼睛是北美有蹄动物中最大的,直径达50mm;其生长位置相比其他食草动物更靠外、靠上。这使它拥有更广的视野,更容易发现靠近的天敌。 而且视觉特别发达,能看到相当于人用8倍双筒望远镜看远处的效果。 但近视能力差, 10米开外的人如果不动的话,叉角羚将很难察觉人的存在。叉角羚是天生好奇的动物,喜欢靠近一些没有明显威胁特征的新东西。猎人常常利用这一点,静坐一处挥动白手帕,来引诱隐藏的叉角羚现身。
与其他反刍的偶蹄动物不同,叉角羚的蹄子没有上蹄(dewclaw)结构,而且侧趾全部消失(这可以看出叉角羚是一种高度进化的偶蹄动物)。叉角羚春季换毛,毛结构上含有复杂的气室,有着优良的保温功能。
叉角羚一个引人注意的特点是特别善于奔跑,是持续高速奔跑最快的动物,其奔跑速度仅次于猎豹的动物(耐久力远强于猎豹),同时能长时间保持高速奔跑。出生4天的羊羔就能比人跑得快。其最高速度可达每小时95公里,而且有着惊人的耐力。能以72公里的时速维持奔跑,远远超于现存任何北美食肉动物的奔跑速度。其他同等体形的食草动物的奔跑速度只及叉角羚的一半。叉角羚惊人的奔跑能力跟已经灭绝的史前分布在北美洲的同样善于奔跑的北美猎豹(Miracinonyx trumani)有关。在北美猎豹的捕食压力下叉角羚进化出了杰出的奔跑能力。
猎豹对高速奔跑的适应是进化出了弹性良好的脊椎骨,而叉角羚敦实的体形对奔跑的适应在于细长的四肢和增大的心脏以及高密度的线粒体。高速奔跑中细长的四肢能跃得更远,叉角羚一跃可达4.5-6米远;增大的心脏有利于氧的代谢,减少运动产生的氧债。 与鹿不同,叉角羚跳高能力特别差,不能跃过围栏,所以长距离的围栏往往会阻碍叉角羚的迁移。
叉角羚生活在宽阔的草原和荒漠地带,地形海拔在900-2400米为多。以灌木叶子为主食,但仍然长有适合吃草的高齿冠牙,偶尔食草。喜群居,夏天以50-100头左右的群体聚集在一起,冬天可达1000头。遇到敌害会用竖立臀部白色的长毛和打响鼻的方法向同伴报警。以尿液和蹄印标记领土。雌羊的性成熟期为16-17个月,孕期长达250天。 第一胎一仔,以后只要在食物充裕的条件下一般每胎两仔。叉角羚的繁殖方式也颇为奇特。雌羊在排卵期会排出4-7个卵子。卵子受精后开始发育,变得细长。细长的受精卵在子宫里绞在一起相互缠绕和推搡。最后多数卵子会因为细胞膜面积减小而死于营养不良,剩下两个卵子最终发育成胚胎。这种子宫内受精卵之间的竞争迄今为止仍然是独一无二的。
叉角羚现在的天敌主要是狼、美洲狮和人。 郊狼、猞猁和金雕则对羊羔构成威胁。 事实上,叉角羚通过与北美猎豹共同进化4百万年在奔跑速度上相互抗衡,以至于达到近100公里的时速。一万年前更新世末期的大灭绝消灭了北美猎豹后,成年叉角羚基本上已经没有什么天敌存在了。因此羊羔成了其他动物攻击叉角羚的主要对象。在缺乏遮掩的大草原上,羊羔主要的御敌方法就是依靠身上的保护色静静地趴在地上不动来避免被敌害发现。
母羊和羊羔之间的默契配合也是一个有趣的现象。一般母羊会在羊羔躲藏处附近绕圈子,同时会装出若无其事的样子来避免被郊狼发现。因为郊狼往往会在可疑的母羊附近耐心观察。母羊对羊羔藏身处过频的张望可以被郊狼利用来找到羊羔。母羊平均每4个小时回到羊羔处喂奶一次。然后羊羔更换藏身处。母羊则迅速离开。母羊的记忆力是惊人的。离开前母羊会转身默记羊羔新的藏身处,这个过程只需3秒。随后的数小时之内母羊即能准确无误的再次找到羊羔。
为了避免敌害发现,羊羔适应长时间静卧的能力仍然是惊人的。在北美西部的3,4月份湿冷的天气中,静卧的羊羔只能通过产生大量的体热来维持体温。此外,不到最后一刻,静卧的羊羔在危险逼近时仍然能维持静止的状态。曾有人在北美野牛和叉角羚共存的草原上发现有些羊羔的脚被路过的野牛蹄子踩断成两截。很显然野牛蹄子踏下来的时候羊羔还是坚持静止状态。
美洲狮偶尔会利用一些丘陵地形来伏击叉角羚。狼群有时候会凭借过人的耐力和体力来攻击叉角羚。但这些都不能对叉角羚构成真正的威胁,除了带枪的人。
叉角羚科史前种类很多,根据已经出土的化石的分类如下:
反刍齿羚亚科的成员体形较小,大约10-18千克,叉角羚亚科成员则大一点,约20-130千克。
现存的叉角羚有一属一种,根据体色、体形和体态分为5个亚种。
从系统发生上来看,叉角羚科是介于牛科和鹿科之间的物种。然而即便DNA分析仍然难以确定叉角羚科与哪个离得更近一些。
据估计叉角羚的数目在白人到达北美洲时大约有3500万头(另说有一亿头),种群规模仅次于北美野牛(Bison bison)。在美国西部垦荒时期数量急剧下降,1924年一度减少至不足3万头。通过保护措施,目前已经恢复到200-300万(包括美国和加拿大)以上。现在是美国西部野外最常见的动物之一,也是美国狩猎业的主要狩猎对象,每年的狩猎配额为4000头。保护级别:低危。
叉角羚墨西哥亚种(A. a. mexicana) 的状态则不佳,仅剩1200头作用,属于濒危级别保护动物。其他数量少受保护的亚种有半岛亚种(A. a. peninsularis ),和索氏亚种(A. a. sonoriensis )
叉角羚CITES保护级别为appendix I, IUCN级别定为A级。
叉角羚(Antilocapra americana)又名“美国羚羊”,仅有一科一属一种。分布于北美洲西部的开阔地带,北起加拿大南部,南到墨西哥北部。叉角羚奔跑速度极快(速度接近猎豹,耐久力远胜于猎豹),以高速耐力奔跑而闻名,长时间高速奔跑,一次跳跃可达6米。出生4天的羊羔就能比人跑得快。其最高速度可达每小时97公里,而且有着惊人的耐力,被誉为地球上最善于耐力奔跑的动物。善游泳。夏季组成小群活动,冬季则集结成上百只的大群。为寻找食物和水源,一年中常进行几次迁移。性机警,视觉敏锐,能看到数千米外的物体。遇险时,臀部的白色毛能立起,这是向同伴告警的一种特殊信号。叉角羚科动物曾经是史前北美食肉类动物北美猎豹、短面熊和恐狼、美洲拟狮、獵豹等动物的主要捕食对象。在美国洛杉矶著名的拉布雷沥青坑(Rancho La Brea)中发现了大量的叉角羚科动物化石。

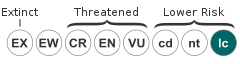
A. a. mexicana メキシコプロングホーン
LOWER RISK - Conservation Dependent (IUCN Red List Ver. 2.3 (1994))A. a. peninsularis カリフォルニアプロングホーン
CRITICALLY ENDANGERED (IUCN Red List Ver. 2.3 (1994))A. a. sonoriensis ソノラプロングホーン
ENDANGERED (IUCN Red List Ver. 2.3 (1994)) 分類 界 : 動物界 Animalia 門 : 脊索動物門 Chordata 亜門 : 脊椎動物亜門 Vertebrata 綱 : 哺乳綱 Mammalia 亜綱 : 獣亜綱 Theria 目 : 鯨偶蹄目 Cetartiodactyla 亜目 : 反芻亜目 Ruminantia 下目 : 真反芻下目 Pecora 上科 : キリン上科 Giraffoidea 科 : プロングホーン科 Antilocapraidae 属 : プロングホーン属 Antilocapra 種 : プロングホーン A. americana 学名 Antilocapra americana (Old, 1815) 和名 プロングホーン 英名 Pronghorn
プロングホーン(Antilocapra americana)は、哺乳綱鯨偶蹄目プロングホーン科プロングホーン属に分類される偶蹄目。現生群では、本種のみでプロングホーン科、プロングホーン属を形成する。別名エダツノレイヨウ。
アメリカ合衆国西部、カナダ南西部(アルバータ州、サスカチュワン州)、メキシコ北部(ソノラ州、バハカリフォルニア州)
体長100-150 cm。肩高60-100 cm。体重36-60 kg。背面は褐色から淡褐色の毛が生える。顎、耳、頚部から腹部、大腿部、臀部には白い毛が生える。
オスは角を持つが、メスの角はないか、あっても小さい。角はシカ科の構成種の様に二股に枝分かれし年に1回生え変わるが、骨質の角ではなく骨の基部の上にウシ科のような角質の鞘でできた角が生える。英名のPronghornは「枝角」の意。
草原や半砂漠地帯に生息する。夏季になるとオスを中心とした10-30匹の小規模な群れを形成するが、冬季は大規模な群れを形成する。オスは縄張りを持つ。走るのが速く最高時速は88kmに達し、さらに時速70km以上の速度を維持しつつ長距離を走ることができるとされ、長距離走においてはチーター以上の速さを誇る動物とされている。なお、そのチーターもかつては北アメリカにも生息していたことが判明しており、プロングホーンの足の速さはチーターから逃げる為に発達したものだという説もある。
食性は草食性で草を食べる。
繁殖形態は胎生で、1回に1-2匹の幼体を出産する。
危険を感じた時には、お尻の毛を逆立て発光して、仲間に伝える。
天敵にはコヨーテがいる。特に幼獣が犠牲になりやすい。
18世紀までは、およそ3,500万-5,000万頭が生息していたと推測されるが、19世紀以降、人間の開発による生息地の破壊や、狩猟の対象とされたことが原因で、生息数が1万頭前後まで激減しアメリカ合衆国東部では絶滅した。現在は45万頭前後まで回復したとされるが、亜種によっては未だ絶滅の危機に瀕している。この点は、同じ地域に生息していたアメリカバイソンについても同様のことが言える。
プロングホーン(Antilocapra americana)は、哺乳綱鯨偶蹄目プロングホーン科プロングホーン属に分類される偶蹄目。現生群では、本種のみでプロングホーン科、プロングホーン属を形成する。別名エダツノレイヨウ。
가지뿔영양(학명 : Antilocapra americana)은 소목 가지뿔영양과에 속하는 북아메리카 프레리 원산인 초식성 포유동물이다. 영칭으로 프롱혼(영어: pronghorn 또는 pronghorn antelope)이라고도 일컬으며, 분류학적으로는 영양과 거리가 멀지만 편의상 아메리카영양(영어: American antelope) 또는 영양붙이라고 불린다. 미국 등지에서는 영양 종류와 매우 닮은 외형 때문에 간략하게 영양으로 줄여 부르기도 한다.[2]
영양붙이과에 딸린 동물 중에서는 유일하게 현존하는 종이며,[3] 플라이스토세 당시에는 같은 영양붙이과의 세 속(†난쟁이가지뿔영양속,[4][5] †스토코케로스속,[6][7] †테트라메릭스속[8])에 속하는 약 12종에 이르는 친척들이 북아메리카 대륙에 더 살고 있었을 것으로 보고 있다.[9]
진반추하목 기린상과에 속하는 동물으로서, 현존하는 동물 중에서 가지뿔영양과 가장 가까운 친척은 기린과 오카피이다. 그러나 평행 진화에 따라 구대륙에 서식하는 영양 종류와 유사한 외모를 갖게 되었기 때문에,[10] 겉보기에는 반추류에 속하는 사슴 및 영양과 가까워 보이며 영양의 한 종류인 것으로 잘못 알려져 있다.
몸길이 110~150cm이며, 어깨높이 82~100cm, 몸무게 36~73kg이다. 적갈색을 띄고 있으며 꼬리와 꼬리 주위는 흰색이다. 암수 모두 뿔이 있다. 뿔은 아예 머리에 붙어 있으며 매년 각질이 떨어지지만 사슴처럼 아예 떨어지지는 않는다.
가지뿔영양(학명 : Antilocapra americana)은 소목 가지뿔영양과에 속하는 북아메리카 프레리 원산인 초식성 포유동물이다. 영칭으로 프롱혼(영어: pronghorn 또는 pronghorn antelope)이라고도 일컬으며, 분류학적으로는 영양과 거리가 멀지만 편의상 아메리카영양(영어: American antelope) 또는 영양붙이라고 불린다. 미국 등지에서는 영양 종류와 매우 닮은 외형 때문에 간략하게 영양으로 줄여 부르기도 한다.
영양붙이과에 딸린 동물 중에서는 유일하게 현존하는 종이며, 플라이스토세 당시에는 같은 영양붙이과의 세 속(†난쟁이가지뿔영양속, †스토코케로스속, †테트라메릭스속)에 속하는 약 12종에 이르는 친척들이 북아메리카 대륙에 더 살고 있었을 것으로 보고 있다.
진반추하목 기린상과에 속하는 동물으로서, 현존하는 동물 중에서 가지뿔영양과 가장 가까운 친척은 기린과 오카피이다. 그러나 평행 진화에 따라 구대륙에 서식하는 영양 종류와 유사한 외모를 갖게 되었기 때문에, 겉보기에는 반추류에 속하는 사슴 및 영양과 가까워 보이며 영양의 한 종류인 것으로 잘못 알려져 있다.
몸길이 110~150cm이며, 어깨높이 82~100cm, 몸무게 36~73kg이다. 적갈색을 띄고 있으며 꼬리와 꼬리 주위는 흰색이다. 암수 모두 뿔이 있다. 뿔은 아예 머리에 붙어 있으며 매년 각질이 떨어지지만 사슴처럼 아예 떨어지지는 않는다.